摘要: 2molCl2含( ) A. 2个氯分子 B. 1.2×1024个氯原子 C. 2 molCl D. 4mol Cl
网址:http://m.1010jiajiao.com/timu3_id_181288[举报]
(08邹县月考)已知:2Fe3+ + 2I- = 2Fe2+ + I2 2Fe2+ + Br2 = 2Fe3+ + 2Br-(不考虑氯气与I2的反应)
(1)含有1molFeI2和2molFeBr2的溶液中通入2molCl2,此时被氧化的离子是 ,
被氧化的离子的物质的量分别是 。反应的离子方程式为 。
(2)如果向含有1molFeI2和2molFeBr2的溶液中通入3molCl2,则被氧化的离子是 ,其对应的氧化产物的物质的量分别是 。反应的离子方程式为 。
(3)若向含有amolFeI2和bmolFeBr2的溶液中通入cmolCl2,当I-、Br-、Fe2+完全被氧化时,c为_________(用含a、b的代数式表示)
查看习题详情和答案>>
| |||||||||||||||
有常见A、B、C、D四种短周期元素,它们的原子序数逐渐增大,A元素原子最外层电子数比B多三个,C元素原子最外层电子数是D元素原子最外层电子数的一半.甲、乙、丙是3种含氧酸的B盐,其焰色反应均呈黄色;甲中含C元素,乙中含D元素,丙中含A元素,甲、丙溶液PH>7,乙溶液PH<7;丁为气体,戊为淡黄色固体.甲、乙、丙、丁、戊、己、庚七种物质之间的相互反应关系如图:
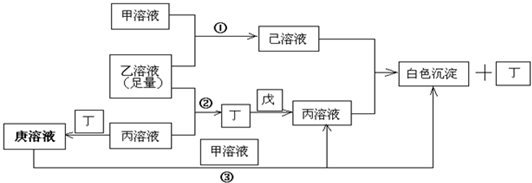
(1)画出D元素原子结构示意简图
 ,戊的电子式
,戊的电子式
 ;
;
(2)丙溶液呈碱性的原因
(3)写出有关反应①②③的离子方程式:
①
②
③
由反应③可得结论:甲和庚溶液的碱性甲
查看习题详情和答案>>

(1)画出D元素原子结构示意简图




(2)丙溶液呈碱性的原因
CO32-水解使溶液呈碱性
CO32-水解使溶液呈碱性
;(3)写出有关反应①②③的离子方程式:
①
AlO2-+4H+=Al3++2H2O
AlO2-+4H+=Al3++2H2O
;②
2H++CO32-=H2O+CO2↑
2H++CO32-=H2O+CO2↑
;③
HCO3-+AlO2-+H2O=CO32-+Al(OH)3↓
HCO3-+AlO2-+H2O=CO32-+Al(OH)3↓
;由反应③可得结论:甲和庚溶液的碱性甲
>
>
庚(填>、<或=).Ⅰ.在一个固定容积的密闭容器中,在一定温度下发生下列反应:
A(g)+B(g) 2C(g),起始加入1molA和2molB,反应达到平衡后测得C的浓度为p mol/L,且C的体积分数为ω.在相同条件下:
2C(g),起始加入1molA和2molB,反应达到平衡后测得C的浓度为p mol/L,且C的体积分数为ω.在相同条件下:
(1)若在相同容器中加入2molA和4molB,达平衡后,C的物质的量浓度为
(2)若在相同容器中加入0.5molC,要求平衡后C的浓度为0.5p mol/L,且C的体积分数为ω,则还应在容器中加入A
(3)若在相同容器中加入a mol A、b mol B、c mol C,并要求平衡后C的浓度为p mol/L,C的体积分数仍为ω,则a、b、c应符合的关系是
Ⅱ.某密闭容器中有如下可逆反应:2SO2 (g)+O2 (g) 2SO3(g),(正反应是放热反应),达到平衡后,其它条件不变时,只改变下列的某一个条件,将变化的情况(增大、减小、不变)填入空格中.
2SO3(g),(正反应是放热反应),达到平衡后,其它条件不变时,只改变下列的某一个条件,将变化的情况(增大、减小、不变)填入空格中.
(1)升高温度,v(正)
(2)加正催化剂,v(正)
(3)保持容器内的压强不变,向容器中充入氩气,SO3的体积分数
查看习题详情和答案>>
A(g)+B(g)
 2C(g),起始加入1molA和2molB,反应达到平衡后测得C的浓度为p mol/L,且C的体积分数为ω.在相同条件下:
2C(g),起始加入1molA和2molB,反应达到平衡后测得C的浓度为p mol/L,且C的体积分数为ω.在相同条件下:(1)若在相同容器中加入2molA和4molB,达平衡后,C的物质的量浓度为
2p
2p
mol/L;(2)若在相同容器中加入0.5molC,要求平衡后C的浓度为0.5p mol/L,且C的体积分数为ω,则还应在容器中加入A
0.25
0.25
mol,B0.75
0.75
mol;(3)若在相同容器中加入a mol A、b mol B、c mol C,并要求平衡后C的浓度为p mol/L,C的体积分数仍为ω,则a、b、c应符合的关系是
a+
c=1,b-a=1
| 1 |
| 2 |
a+
c=1,b-a=1
(其中一个只含a和b,另一个只含a和c).| 1 |
| 2 |
Ⅱ.某密闭容器中有如下可逆反应:2SO2 (g)+O2 (g)
 2SO3(g),(正反应是放热反应),达到平衡后,其它条件不变时,只改变下列的某一个条件,将变化的情况(增大、减小、不变)填入空格中.
2SO3(g),(正反应是放热反应),达到平衡后,其它条件不变时,只改变下列的某一个条件,将变化的情况(增大、减小、不变)填入空格中.(1)升高温度,v(正)
增大
增大
,v(逆)增大
增大
,SO2 的转化率减小
减小
.(2)加正催化剂,v(正)
增大
增大
,v(逆)增大
增大
,O2 的物质的量不变
不变
.(3)保持容器内的压强不变,向容器中充入氩气,SO3的体积分数
增大
增大
,SO2的浓度减小
减小
.在温度一定的条件下,向一密闭容器中加入4mol SO2和3mol O2,发生反应:2SO2(g)+O2 (g)?2SO3(g)△H<O,达到平衡后,生成了a mol SO3.
(1)温度升高,该反应的化学平衡常K值
(2)SO2的转化率为
(3)若该反应是在恒温恒压的密闭容器中进行的.现加入8molSO2和6mol O2,达到平衡后SO3气体的物质的量为
查看习题详情和答案>>
(1)温度升高,该反应的化学平衡常K值
减小
减小
(填增大、减小、可能增大也可能减小).(2)SO2的转化率为
0.25a
0.25a
(用字母a的表达式表示)(3)若该反应是在恒温恒压的密闭容器中进行的.现加入8molSO2和6mol O2,达到平衡后SO3气体的物质的量为
2a
2a
mol (用字母a表示).如在同样的条件下,加入3molSO2、3mol O2、x molSO3气体,达平衡后SO3在反应混合气中的体积分数与原平衡相同,则x=3
3
,平衡后SO3的物质的量是1.5a
1.5a
mol.(用含a的表达式表示)