题目内容
在温度一定的条件下,向一密闭容器中加入4mol SO2和3mol O2,发生反应:2SO2(g)+O2 (g)?2SO3(g)△H<O,达到平衡后,生成了a mol SO3.
(1)温度升高,该反应的化学平衡常K值
(2)SO2的转化率为
(3)若该反应是在恒温恒压的密闭容器中进行的.现加入8molSO2和6mol O2,达到平衡后SO3气体的物质的量为
(1)温度升高,该反应的化学平衡常K值
减小
减小
(填增大、减小、可能增大也可能减小).(2)SO2的转化率为
0.25a
0.25a
(用字母a的表达式表示)(3)若该反应是在恒温恒压的密闭容器中进行的.现加入8molSO2和6mol O2,达到平衡后SO3气体的物质的量为
2a
2a
mol (用字母a表示).如在同样的条件下,加入3molSO2、3mol O2、x molSO3气体,达平衡后SO3在反应混合气中的体积分数与原平衡相同,则x=3
3
,平衡后SO3的物质的量是1.5a
1.5a
mol.(用含a的表达式表示)分析:(1)升高温度平衡向吸热方向进行;
(2)依据化学平衡三段式和转化率概念列式计算;
(3)恒温恒压条件下平衡不移动,在恒温恒容条件下,对于气体有变化的可逆反应,若初始加入的各个同种物质的物质的量相同或成正比,则两平衡等效.
(2)依据化学平衡三段式和转化率概念列式计算;
(3)恒温恒压条件下平衡不移动,在恒温恒容条件下,对于气体有变化的可逆反应,若初始加入的各个同种物质的物质的量相同或成正比,则两平衡等效.
解答:解:(1)升高温度平衡向吸热方向进行,即向逆反应方向进行,平衡常数减小,故答案为:减小;
(2)SO2的平衡转化率=
×100%=0.25a,故答案为:0.25a;
(3)恒温恒压条件下平衡不移动,起始物质的量扩大一倍,则平衡液扩大一倍,即SO3气体的物质的量为2amol;初始加入的各个同种物质的物质的量比值相同,
=
,则X=3;则与起始加入6mol二氧化硫和4.5mol氧气等效,平衡后SO3的物质的量是1.5amol,故答案为:2a;1;1.5a.
(2)SO2的平衡转化率=
| a |
| 4 |
(3)恒温恒压条件下平衡不移动,起始物质的量扩大一倍,则平衡液扩大一倍,即SO3气体的物质的量为2amol;初始加入的各个同种物质的物质的量比值相同,
| 3+X |
| 3+0.5X |
| 4 |
| 3 |
点评:本题考查了化学平衡的计算,平衡常数和转化率概念的应用,(3)是易错点,题目难度中等.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
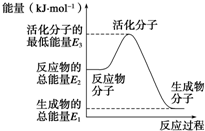 已知:①N2(g)+O2(g)═2NO(g)△H1=+180kJ?mol-1
已知:①N2(g)+O2(g)═2NO(g)△H1=+180kJ?mol-1②N2(g)+3H2(g)?2NH3(g)△H2=-92.4kJ?mol-1
③2H2(g)+O2(g)═2H2O(g)△H3=-483.6kJ?mol-1
下列说法正确的是( )
| A、反应②中的能量变化如图所示,则△H2=E1-E3 | B、H2的燃烧热为241.8 kJ?mol-1 | C、由反应②知在温度一定的条件下,在一恒容密闭容器中通入1 mol N2和3 mol H2,反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2充分反应后放出的热量为Q2 kJ,则184.8>Q2>2Q1 | D、氨的催化氧化反应为4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=+906 kJ?mol-1 |
 2NH3(g) ΔH2=-92.4 kJ·mol-1
2NH3(g) ΔH2=-92.4 kJ·mol-1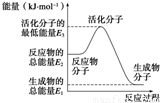
 cC(g)达到化学平衡后,C的物质的量浓度为kmol·L—1。若在温度一定的条件下,将密闭容器容积变为原来的1/2后,C的物质的量浓度为2kmol·L—1,且始终不变。则b、c关系是
cC(g)达到化学平衡后,C的物质的量浓度为kmol·L—1。若在温度一定的条件下,将密闭容器容积变为原来的1/2后,C的物质的量浓度为2kmol·L—1,且始终不变。则b、c关系是 cC(g)
cC(g)