摘要:61.从20世纪中叶开始.硅成了信息技术的关键材料.是目前应用最多的半导体材料.请回答-下列问题: (1)地壳里各种元素的含量如右图所示.其中表示硅元素的是 . (2)根据元素周期表可知.原子序数为6的碳原子和原子序数为14的硅原子最外层电子数均为4.则常温下硅的化学性质 (选琐“活泼 .“不活泼 ). (3)制备硅半导体材料必须先得到高纯硅.三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法.生产过程示意如下: ①整个制备过程必须达到无水无氧.在H2还原SiHCl3过程中若混入O2 .可能引起的后果是 . ②在生产过程中物质A可循环使用.A的化学式是 ,在生产过程中还有一种可循环使用的物质是 . 答案:①硅被氧化得不到高纯硅 引起爆炸 ②HCl 氢气(H2)
网址:http://m.1010jiajiao.com/timu3_id_18028[举报]
从20世纪中叶开始,硅成了信息技术的关键材料,是目前应用最多的半导体材料.请回答-下列问题:
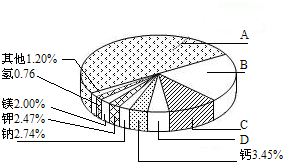
(1)地壳里各种元素的含量(质量分数)如右图所示,其中表示硅元素的是 (填字母).
(2)根据元素周期表可知,原子序数为6的碳原子和原子序数为14的硅原子最外层电子数均为4,则常温下硅的化学性质 (选填“活泼”、“不活泼”).
(3)制备硅半导体材料必须先得到高纯硅,三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法.生产过程示意如下:
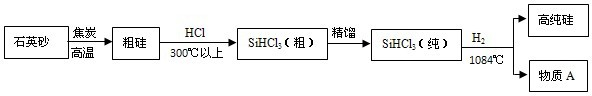
①整个制备过程必须达到无水无氧.在H2还原SiHCl3过程中若混入O2,可能引起的后果是
②由粗硅制取三氯甲硅烷的化学方程式为 .
③在生产过程中物质A可循环使用,A的化学式是 ;在生产过程中还有一种可循环使用的物质是 .
查看习题详情和答案>>
(1)地壳里各种元素的含量(质量分数)如右图所示,其中表示硅元素的是

(2)根据元素周期表可知,原子序数为6的碳原子和原子序数为14的硅原子最外层电子数均为4,则常温下硅的化学性质
(3)制备硅半导体材料必须先得到高纯硅,三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法.生产过程示意如下:

①整个制备过程必须达到无水无氧.在H2还原SiHCl3过程中若混入O2,可能引起的后果是
②由粗硅制取三氯甲硅烷的化学方程式为
③在生产过程中物质A可循环使用,A的化学式是
从20世纪中叶开始,硅成了信息技术的关键材料,是目前应用最多的半导体材料.请回答下列问题:
(1)根据元素周期表可知,原子序数为6的碳原子和原子序数为14的硅原子最外层电子数均为4,则常温下硅的化学性质
(2)硅在自然界中含量比较丰富,主要以硅酸盐和石英砂存在于地壳中,石英砂的主要成分是二氧化硅,请写出二氧化硅的化学式
(3)制备硅半导体材料必须先得到高纯硅,三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法.生产过程示意如图:

①整个制备过程必须达到无水无氧.在H2还原SiHCl3过程中若混入O2,可能引起的后果是
②在生产过程中物质A可循环使用,A的化学式是
查看习题详情和答案>>
(1)根据元素周期表可知,原子序数为6的碳原子和原子序数为14的硅原子最外层电子数均为4,则常温下硅的化学性质
不活泼
不活泼
(填“活泼”或“不活泼”).(2)硅在自然界中含量比较丰富,主要以硅酸盐和石英砂存在于地壳中,石英砂的主要成分是二氧化硅,请写出二氧化硅的化学式
SiO2
SiO2
.(3)制备硅半导体材料必须先得到高纯硅,三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法.生产过程示意如图:

①整个制备过程必须达到无水无氧.在H2还原SiHCl3过程中若混入O2,可能引起的后果是
爆炸
爆炸
.②在生产过程中物质A可循环使用,A的化学式是
HCl
HCl
;在生产过程中还有一种可循环使用的物质是H2
H2
. 从20世纪中叶开始,硅成了信息技术的关键材料,是目前应用最多的半导体材料.请回答下列问题:
从20世纪中叶开始,硅成了信息技术的关键材料,是目前应用最多的半导体材料.请回答下列问题:(1)地壳里各种元素的含量(质量分数)如图所示,其中表示硅元素的是
B
B
(填字母).(2)根据元素周期表可知,硅的原子序数为14,则其原子最外层电子数为
4
4
. ,从中不能获得的信息是
,从中不能获得的信息是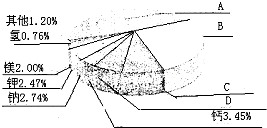 从20世纪中叶开始,硅成了信息技术的关键材料,是目前应用最多的半导体材料.请回答下列问题:
从20世纪中叶开始,硅成了信息技术的关键材料,是目前应用最多的半导体材料.请回答下列问题: