题目内容
从20世纪中叶开始,硅成了信息技术的关键材料,是目前应用最多的半导体材料.请回答下列问题:
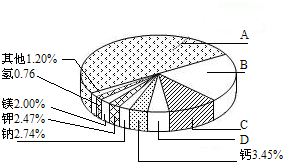
(1)硅元素在地壳里的含量(质量分数)仅次于 ,从中不能获得的信息是
,从中不能获得的信息是
①硅原子的质子数为14 ②常温下,硅的化学性质不活泼
③硅原子有3个电子层 ④硅的相对原子质量为28
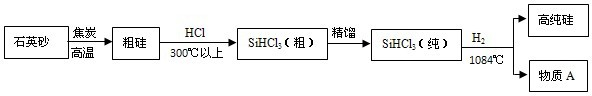
(2)制备硅半导体必须先得到高纯硅,三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法:SiHCl3+H2
Si+3X.那么X的化学式是
(1)硅元素在地壳里的含量(质量分数)仅次于
氧
氧
元素.在地壳中常以+4价氧化物的形式存在,写出该氧化物的化学式SiO2
SiO2
;已知硅元素的原子结构示意图为 ,从中不能获得的信息是
,从中不能获得的信息是④
④
.①硅原子的质子数为14 ②常温下,硅的化学性质不活泼
③硅原子有3个电子层 ④硅的相对原子质量为28
(2)制备硅半导体必须先得到高纯硅,三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法:SiHCl3+H2
| 1084℃ |
HCl
HCl
.分析:(1)根据地壳中元素的含量可以知道,排在前四位的元素为:氧硅铝铁;根据化合物中正负化合价的代数和为0可以写出硅的氧化物的化学式,然后根据原子结构示意图的意义进行解答即可;
(2)根据质量守恒定律的实质进行解答.
(2)根据质量守恒定律的实质进行解答.
解答:解:(1)根据地壳中元素的含量可以知道,排在前四位的元素为:氧、硅、铝、铁;根据化合物中正负化合价的代数和为0可以写出硅的氧化物的化学式为SiO2,然后根据原子结构示意图的意义可以知道,图中可以得到的信息为:①硅原子的质子数为14 ②常温下,硅的化学性质不活泼
③硅原子有3个电子层,但是得不出硅的相对原子质量为28,故选④;
(2)根据质量守恒定律的实质可以知道反应前后原子的种类和数目相等,反应前:1个Si,3个H,3个Cl,反应后:1个Si,所以可以判断在3X中含有3个H,33个Cl,所以可以判断X的化学式为HCl.
故答案为:
(1)氧;SiO2;④;
(2)HCl.
③硅原子有3个电子层,但是得不出硅的相对原子质量为28,故选④;
(2)根据质量守恒定律的实质可以知道反应前后原子的种类和数目相等,反应前:1个Si,3个H,3个Cl,反应后:1个Si,所以可以判断在3X中含有3个H,33个Cl,所以可以判断X的化学式为HCl.
故答案为:
(1)氧;SiO2;④;
(2)HCl.
点评:学会结合课本知识,学会进行知识的大胆迁移的方法;掌握地壳中元素的含量和分布.

练习册系列答案
相关题目
 从20世纪中叶开始,硅成了信息技术的关键材料,是目前应用最多的半导体材料.请回答下列问题:
从20世纪中叶开始,硅成了信息技术的关键材料,是目前应用最多的半导体材料.请回答下列问题:
 从20世纪中叶开始,硅成了信息技术的关键材料,是目前应用最多的半导体材料.请回答下列问题:
从20世纪中叶开始,硅成了信息技术的关键材料,是目前应用最多的半导体材料.请回答下列问题: