题目内容
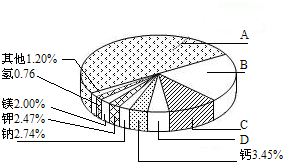
从20世纪中叶开始,硅成了信息技术的关键材料,是目前应用最多的半导体材料.请回答-下列问题:(1)地壳里各种元素的含量(质量分数)如右图所示,其中表示硅元素的是
(2)根据元素周期表可知,原子序数为6的碳原子和原子序数为14的硅原子最外层电子数均为4,则常温下硅的化学性质
(3)制备硅半导体材料必须先得到高纯硅,三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法.生产过程示意如下:
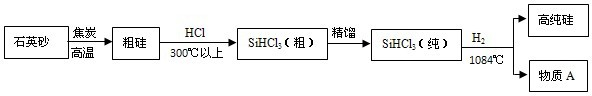
①整个制备过程必须达到无水无氧.在H2还原SiHCl3过程中若混入O2,可能引起的后果是
②由粗硅制取三氯甲硅烷的化学方程式为
③在生产过程中物质A可循环使用,A的化学式是
分析:根据元素在地壳中分布于含量和分析制备硅半导体的生产过程示意图推断产物,解答本题.
解答:解:(1)地壳里各元素的含量由多到少的顺序排列依次是氧,硅,铝,铁,根据图所示可推断出表示硅元素的是B;故选B;
(2)元素的化学性质跟它的原子的最外层电子数目关系非常密切,原子序数为6的碳原子和原子序数为14的硅原子最外层电子数均为4,常温下硅的化学性质相对较稳定,故答案为:不活泼;
(3)①在H2还原SiHCl3过程中若混入O2,H2与O2在高温下容易爆炸,Si与O2生成氧化物,
故答案为:爆炸或硅被氧化或得不到高纯硅;
②由粗硅制取三氯甲硅烷的化学方程式,故答案为:Si+3HCl
SiHCl3+H2,
③H2还原SiHCl3的化学方程式 SiHCl3+H2
Si+3HCl,在生产过程中物质A 的化学式是HCl;
在上述生产流程中由粗硅到三氯甲硅烷和由三氯甲硅烷到高纯硅是两个相反的过程,所以这些过程中,H2、HCl可以循环使用;因此在生产过程中另一种可循环使用的物质是 由粗硅制取三氯甲硅烷的产物H2,故答案为:HCl; H2 .
(2)元素的化学性质跟它的原子的最外层电子数目关系非常密切,原子序数为6的碳原子和原子序数为14的硅原子最外层电子数均为4,常温下硅的化学性质相对较稳定,故答案为:不活泼;
(3)①在H2还原SiHCl3过程中若混入O2,H2与O2在高温下容易爆炸,Si与O2生成氧化物,
故答案为:爆炸或硅被氧化或得不到高纯硅;
②由粗硅制取三氯甲硅烷的化学方程式,故答案为:Si+3HCl
| ||
③H2还原SiHCl3的化学方程式 SiHCl3+H2
| ||
在上述生产流程中由粗硅到三氯甲硅烷和由三氯甲硅烷到高纯硅是两个相反的过程,所以这些过程中,H2、HCl可以循环使用;因此在生产过程中另一种可循环使用的物质是 由粗硅制取三氯甲硅烷的产物H2,故答案为:HCl; H2 .
点评:本题考查元素在地壳中分布于含量和制备硅半导体的生产过程示意图推断产物的解题能力.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案
相关题目
 从20世纪中叶开始,硅成了信息技术的关键材料,是目前应用最多的半导体材料.请回答下列问题:
从20世纪中叶开始,硅成了信息技术的关键材料,是目前应用最多的半导体材料.请回答下列问题:
 ,从中不能获得的信息是
,从中不能获得的信息是 从20世纪中叶开始,硅成了信息技术的关键材料,是目前应用最多的半导体材料.请回答下列问题:
从20世纪中叶开始,硅成了信息技术的关键材料,是目前应用最多的半导体材料.请回答下列问题: