摘要:用质量分数为的浓盐酸(其密度为)按浓盐酸与水的体积比为1:3配制成系盐酸(其密度为).则随配制稀盐酸的物质的量浓度为 A. B. C. D. 第II卷
网址:http://m.1010jiajiao.com/timu3_id_178691[举报]
(14分)短周期主族元素A、B、C、D、E原子序数依次增大 , A是元素周期表中原子半径最小的元素,B是形成化合物种类最多的元素,C原子的最外层电子数是次外层电子数的3倍,D是同周期中金属性最强的元素,E的负一价离子与C的某种氢化物分子含有相同的电子数。
⑴A、C、D形成的化合物中含有的化学键类型为 。
⑵已知:
① E-E→2E ?H=+a kJ/mol;
② 2A→A-A ?H=-b kJ/mol;
③ E+A→A-E ?H=-c kJ/mol;
写出298K时,A2与E2反应的热化学方程式 。
⑶在某温度下容积均为2 L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2A2(g)+BC(g) X(g) ?H=-Q kJ/mol(Q>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
X(g) ?H=-Q kJ/mol(Q>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
| 实验 | 甲 | 乙 | 丙 |
| 初始投料 | 2 mol A2、1 mol BC | 1 mol X | 4 mol A2、2 mol BC |
| 平衡时n(X) | 0.5 mol | n2 | n3 |
| 反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
| 体系的压强 | P1 | P2 | P3 |
| 反应物的转化率 |  1 1 |  2 2 |  3 3 |
v (A2)= 。
② 计算该温度下此反应的平衡常数K = 。
③三个容器中的反应分别达平衡时下列各组数据关系正确的是 (填字母)。
A.α1+α2=1 B.Q1+Q2=Q C.α3<α1
D.P3<2P1=2P2 E.n2<n3<1.0 mol F.Q3=2Q1
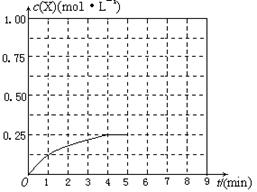
④在其他条件不变的情况下,将甲容器的体积压缩到1 L,若在第8min达到新的平衡时A2的总转化率为75%,请在下图中画出第5min 到新平衡时X的物质的量浓度的变化曲线。
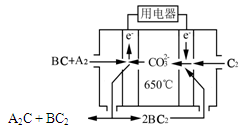
⑷熔融碳酸盐燃料电池(MCFC)是一种高温燃料电池,被称为第二代燃料电池,是未来民用发电的理想选择方案之一,其工作原理如图所示。现以A2(g)、BC(g)为燃料,以一定比例Li2CO3和Na2CO3低熔混合物为电解质。写出该碳酸盐燃料电池(MCFC)正极的电极反应式____________________________。
 查看习题详情和答案>>
查看习题详情和答案>>
(14分)短周期主族元素A、B、C、D、E原子序数依次增大 , A是元素周期表中原子半径最小的元素,B是形成化合物种类最多的元素,C原子的最外层电子数是次外层电子数的3倍,D是同周期中金属性最强的元素,E的负一价离子与C的某种氢化物分子含有相同的电子数。
⑴A、C、D形成的化合物中含有的化学键类型为 。
⑵已知:
① E-E→2E ?H=+a kJ/mol;
② 2A→A-A ?H=-b kJ/mol;
③ E+A→A-E ?H=-c kJ/mol;
写出298K时,A2与E2反应的热化学方程式 。
⑶在某温度下容积均为2 L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2A2(g)+BC(g) X(g) ?H=-Q kJ/mol(Q>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
X(g) ?H=-Q kJ/mol(Q>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
①在该温度下,假设甲容器从反应开始到平衡所需时间为4 min,则A2的平均反应速率
v (A2)= 。
② 计算该温度下此反应的平衡常数K = 。
③三个容器中的反应分别达平衡时下列各组数据关系正确的是 (填字母)。
A.α1+α2=1 B.Q1+Q2=Q C.α3<α1
D.P3<2P1=2P2 E.n2<n3<1.0 mol F.Q3=2Q1
④在其他条件不变的情况下,将甲容器的体积压缩到1 L,若在第8min达到新的平衡时A2的总转化率为75%,请在下图中画出第5min 到新平衡时X的物质的量浓度的变化曲线。

⑷熔融碳酸盐燃料电池(MCFC)是一种高温燃料电池,被称为第二代燃料电池,是未来民用发电的理想选择方案之一,其工作原理如图所示。现以A2(g)、BC(g)为燃料,以一定比例Li2CO3和Na2CO3低熔混合物为电解质。写出该碳酸盐燃料电池(MCFC)正极的电极反应式____________________________。

⑴A、C、D形成的化合物中含有的化学键类型为 。
⑵已知:
① E-E→2E ?H=+a kJ/mol;
② 2A→A-A ?H=-b kJ/mol;
③ E+A→A-E ?H=-c kJ/mol;
写出298K时,A2与E2反应的热化学方程式 。
⑶在某温度下容积均为2 L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2A2(g)+BC(g)
 X(g) ?H=-Q kJ/mol(Q>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
X(g) ?H=-Q kJ/mol(Q>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:| 实验 | 甲 | 乙 | 丙 |
| 初始投料 | 2 mol A2、1 mol BC | 1 mol X | 4 mol A2、2 mol BC |
| 平衡时n(X) | 0.5 mol | n2 | n3 |
| 反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
| 体系的压强 | P1 | P2 | P3 |
| 反应物的转化率 |  1 1 |  2 2 |  3 3 |
v (A2)= 。
② 计算该温度下此反应的平衡常数K = 。
③三个容器中的反应分别达平衡时下列各组数据关系正确的是 (填字母)。
A.α1+α2=1 B.Q1+Q2=Q C.α3<α1
D.P3<2P1=2P2 E.n2<n3<1.0 mol F.Q3=2Q1
④在其他条件不变的情况下,将甲容器的体积压缩到1 L,若在第8min达到新的平衡时A2的总转化率为75%,请在下图中画出第5min 到新平衡时X的物质的量浓度的变化曲线。

⑷熔融碳酸盐燃料电池(MCFC)是一种高温燃料电池,被称为第二代燃料电池,是未来民用发电的理想选择方案之一,其工作原理如图所示。现以A2(g)、BC(g)为燃料,以一定比例Li2CO3和Na2CO3低熔混合物为电解质。写出该碳酸盐燃料电池(MCFC)正极的电极反应式____________________________。

实验室常用浓盐酸的质量分数为36.5%,密度为1.20g/cm-3,配制100mL 3.00mol/L的稀盐酸,需以上浓盐酸
(1)在配制溶液时实验室应提供烧杯、量筒、100ml容量瓶、
(2)使用容量瓶前必须进行的一步操作是
(3)用浓盐酸配制该稀盐酸需要以下哪些步骤(按操作顺序填写序号):
①计算 ②.装瓶 ③.用50mL量筒量取一定体积的浓盐酸
④洗涤 ⑤.移液 ⑥.稀释 ⑦.定容 ⑧.摇匀 ⑨.振荡
(4)在配制过程中其它操作都正确,下列操作会引起所配溶液浓度偏小的是
①没有洗涤烧杯和玻璃棒;②容量瓶中含有少量蒸馏水;③定容时俯视标线;④定容时仰视标线;
(5)MnO2 和浓盐酸的反应中( MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O ),如果有34.8g MnO2 被还原,被氧化的HCl有
查看习题详情和答案>>
25ml
25ml
.(1)在配制溶液时实验室应提供烧杯、量筒、100ml容量瓶、
璃棒
璃棒
、胶头滴管
胶头滴管
.(2)使用容量瓶前必须进行的一步操作是
查漏
查漏
(3)用浓盐酸配制该稀盐酸需要以下哪些步骤(按操作顺序填写序号):
①③⑥⑤④⑦⑧②
①③⑥⑤④⑦⑧②
.①计算 ②.装瓶 ③.用50mL量筒量取一定体积的浓盐酸
④洗涤 ⑤.移液 ⑥.稀释 ⑦.定容 ⑧.摇匀 ⑨.振荡
(4)在配制过程中其它操作都正确,下列操作会引起所配溶液浓度偏小的是
①④
①④
①没有洗涤烧杯和玻璃棒;②容量瓶中含有少量蒸馏水;③定容时俯视标线;④定容时仰视标线;
(5)MnO2 和浓盐酸的反应中( MnO2+4HCl(浓)
| ||
29.2
29.2
克,生成氯气在标况下的体积8.96
8.96
L.下图为实验室某浓盐酸试剂瓶的标签,试根据标签上的有关数据回答下列问题
| 盐酸 分子式:HCl 相对分子质量:36.5 密度:1.19g/mL HCl的质量分数:36.5%(1)该浓盐酸中HCl的物质的量浓度为 11.9mol/L 11.9mol/L .(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是 BD BD (填编号).A.溶液中HCl的物质的量B.溶液的浓度C.溶液中Cl-的数目D.溶液的密度 (3)某学生欲用上述浓盐酸和蒸馏水配制500mL物质的量浓度为0.400mol/L的稀盐酸.该该学生需要量取 16.8 16.8 mL(小数点后保留一位)上述浓盐酸进行配制.②现有a.10mL量筒;b.25mL量筒;c.烧杯;d.托盘天平.e.500mL容量瓶;f.胶头滴管;g.玻璃棒,请从其中选取必要的仪器,按各仪器第一次使用先后顺序排序: bcgef或bfcge bcgef或bfcge (填编号).③在配制过程中,下列实验操作对所配制盐酸物质的量浓度有何影响?(在空格中填“偏高”、“偏低”或“无影响”):定容时俯视观察 偏高 偏高 ;定容后经振荡、摇匀、静置后,发现液面下降,再加适量的蒸馏水偏低 偏低 .
查看习题详情和答案>>
下图为实验室某浓盐酸试剂瓶的标签,试根据标签上的有关数据回答下列问题
查看习题详情和答案>>
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是 (填编号). A.溶液中HCl的物质的量B.溶液的浓度C.溶液中Cl-的数目D.溶液的密度 (3)某学生欲用上述浓盐酸和蒸馏水配制500mL物质的量浓度为0.400mol/L的稀盐酸.该该学生需要量取 mL(小数点后保留一位)上述浓盐酸进行配制. ②现有a.10mL量筒;b.25mL量筒;c.烧杯;d.托盘天平.e.500mL容量瓶;f.胶头滴管;g.玻璃棒,请从其中选取必要的仪器,按各仪器第一次使用先后顺序排序: (填编号). ③在配制过程中,下列实验操作对所配制盐酸物质的量浓度有何影响?(在空格中填“偏高”、“偏低”或“无影响”):定容时俯视观察 ;定容后经振荡、摇匀、静置后,发现液面下降,再加适量的蒸馏水 . |