摘要:懂得质量数和X的含义.
网址:http://m.1010jiajiao.com/timu3_id_177799[举报]
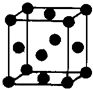 (2012?武汉模拟)[化学一选修 3:物质结构与性质]有U、V、W、X、Y、Z 六种前四周期元素,原子序数依次增大,其相关信息如下表:
(2012?武汉模拟)[化学一选修 3:物质结构与性质]有U、V、W、X、Y、Z 六种前四周期元素,原子序数依次增大,其相关信息如下表:| 元素编号 | 相关信息比 |
| U | 所处的周期数、族序数分别与其原子序数相等 |
| V | 基态时,电子分布在三个能级上,且各能级中电子数相等 |
| W | 基态时,2p 轨道处于半充满状态 |
| X | 与W元素处于同一周期,且X的第一电离能小于W的第一电离 |
| Y | 是第四周期元素中未成对电子数最多的元素 |
| Z | Z 的一种核素的质量数为65,中子数为 36 |
(1)U、V两种元素组成的一种化合物甲是重要的化工原料,常把它的产量作为衡量石油化工发展水平的标志,则甲分子中σ键和π键的个数比为
5:1
5:1
,其中心原子采取sp2
sp2
杂化;(2)V与W原子结合形成的V3W4晶体,其硬度比金刚石大,则V3W4晶体中含
共价
共价
键,属于原子
原子
晶体;(3)Y 的基态原子的核外电子排布式为
[Ar]3d54s1
[Ar]3d54s1
;(4)乙和丙分别是V和X的氢化物,这两种氢化物分子中都含有 18 个电子.乙和丙的化学式分别是
C2H6
C2H6
、H2O2
H2O2
,两者沸点的关系为乙<
<
丙(填“>”或“<”),原因是H2O2分子见存在氢键,C2H6分子间不存在氢键
H2O2分子见存在氢键,C2H6分子间不存在氢键
;(5)Z单质晶体的晶胞如右图所示,其配位数为:
12
12
.W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强。下列说法正确的是

A.对应简单离子半径:X>W
B.对应气态氢化物的稳定性Y>Z
C.化合物XZW既含离子键,又含共价键
D.Y的氧化物能与Z的氢化物和X的最高价氧化物对应的水化物的溶液反应
查看习题详情和答案>>
U、V、W、X、Y、Z六种原子序数依次增大前20号元素,其中U和X,W和Y分别在同一主族,Y的原子序数是W的原子序数两倍,Z的原子序数是U和X的原子序数之和.根据以上条件回答下列问题:
(1)写出U、V组成的阴离子(U、V都满足8电子稳定结构)和Z的阳离子形成的化合物的电子式: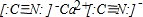
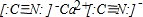 ;
;
(2)W元素可分别U、Y形成多种常见的阴离子.某溶液是由其中若干种阴离子组成的无机钠盐溶液,为了检验该溶液中的阴离子,分别取两份溶液进行如下实验:
①第一份溶液中加入足量盐酸溶液,只产生无色气体;
②第二份溶液中加入足量的BaCl2溶液,有白色沉淀产生,再加入足量的稀HNO3,白色沉淀质量减少.
由此得出的结论是
查看习题详情和答案>>
(1)写出U、V组成的阴离子(U、V都满足8电子稳定结构)和Z的阳离子形成的化合物的电子式:
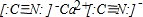
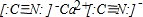
(2)W元素可分别U、Y形成多种常见的阴离子.某溶液是由其中若干种阴离子组成的无机钠盐溶液,为了检验该溶液中的阴离子,分别取两份溶液进行如下实验:
①第一份溶液中加入足量盐酸溶液,只产生无色气体;
②第二份溶液中加入足量的BaCl2溶液,有白色沉淀产生,再加入足量的稀HNO3,白色沉淀质量减少.
由此得出的结论是
一定含有碳酸根离子,亚硫酸根离子和硫酸根离子至少有一种
一定含有碳酸根离子,亚硫酸根离子和硫酸根离子至少有一种
.溶液的配制过程能引起浓度偏高的是( )
①用1g 98%的浓硫酸加4g水配19.6%的硫酸
②配制一定物质的量浓度的硫酸溶液时,定容后,塞好塞子倒转摇匀后,发现液面低于刻度线.
③10%的硫酸和90%的硫酸等体积混合配制50%的硫酸溶液
④在80mL水中加入18.4mol/L的硫酸20mL,配制3.68mol/L的硫酸溶液
⑤质量分数为5x%和x%的两种氨水等体积混合配成3x%的氨水.
①用1g 98%的浓硫酸加4g水配19.6%的硫酸
②配制一定物质的量浓度的硫酸溶液时,定容后,塞好塞子倒转摇匀后,发现液面低于刻度线.
③10%的硫酸和90%的硫酸等体积混合配制50%的硫酸溶液
④在80mL水中加入18.4mol/L的硫酸20mL,配制3.68mol/L的硫酸溶液
⑤质量分数为5x%和x%的两种氨水等体积混合配成3x%的氨水.
| A、①③⑤ | B、②④⑤ | C、③④ | D、④⑤ |
(2011?兖州市三模)聚合氯化铝晶体的化学式为[Al2(OH)nCl6-n?XH2O]m,它是一种高效无机水处理剂,它的制备原理是调节增大AlCl3溶液的pH,通过促进其水解而结晶析出.其制备原料主要是铝加工行业的废渣--铝灰,它主要含Al2O3、Al,还有SiO2等杂质.聚合氯化铝生产的工艺流程如下:

(1)搅拌加热操作过程中发生反应的离子方程式为:
(2)生产过程中B和D的操作名称分别是
(3)反应中副产品a是
(4)生产过程中可循环使用的物质是
(5)调节pH至4.0~4.5的目的是
(6)实验室要测定水处理剂产品中n和x的值.为使测定结果更准确,需得到的晶体较纯净.生产过程C物质可选用
A.NaOH B.Al C.氨水 D.Al2O3 E.NaAlO2.
查看习题详情和答案>>

(1)搅拌加热操作过程中发生反应的离子方程式为:
Al2O3+6H+=2Al3++3H2O
Al2O3+6H+=2Al3++3H2O
;2Al+6H+=2Al3++3H2↑
2Al+6H+=2Al3++3H2↑
.(2)生产过程中B和D的操作名称分别是
过滤
过滤
和过滤
过滤
(B和D均为简单操作).(3)反应中副产品a是
H2
H2
.(4)生产过程中可循环使用的物质是
HCl
HCl
(用化学式表示).(5)调节pH至4.0~4.5的目的是
促进AlCl3水解,使晶体析出
促进AlCl3水解,使晶体析出
.(6)实验室要测定水处理剂产品中n和x的值.为使测定结果更准确,需得到的晶体较纯净.生产过程C物质可选用
BD
BD
.A.NaOH B.Al C.氨水 D.Al2O3 E.NaAlO2.