题目内容
U、V、W、X、Y、Z六种原子序数依次增大前20号元素,其中U和X,W和Y分别在同一主族,Y的原子序数是W的原子序数两倍,Z的原子序数是U和X的原子序数之和.根据以上条件回答下列问题:
(1)写出U、V组成的阴离子(U、V都满足8电子稳定结构)和Z的阳离子形成的化合物的电子式: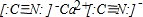
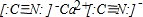 ;
;
(2)W元素可分别U、Y形成多种常见的阴离子.某溶液是由其中若干种阴离子组成的无机钠盐溶液,为了检验该溶液中的阴离子,分别取两份溶液进行如下实验:
①第一份溶液中加入足量盐酸溶液,只产生无色气体;
②第二份溶液中加入足量的BaCl2溶液,有白色沉淀产生,再加入足量的稀HNO3,白色沉淀质量减少.
由此得出的结论是
(1)写出U、V组成的阴离子(U、V都满足8电子稳定结构)和Z的阳离子形成的化合物的电子式:
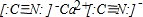
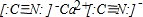
(2)W元素可分别U、Y形成多种常见的阴离子.某溶液是由其中若干种阴离子组成的无机钠盐溶液,为了检验该溶液中的阴离子,分别取两份溶液进行如下实验:
①第一份溶液中加入足量盐酸溶液,只产生无色气体;
②第二份溶液中加入足量的BaCl2溶液,有白色沉淀产生,再加入足量的稀HNO3,白色沉淀质量减少.
由此得出的结论是
一定含有碳酸根离子,亚硫酸根离子和硫酸根离子至少有一种
一定含有碳酸根离子,亚硫酸根离子和硫酸根离子至少有一种
.分析:根据U、V、W、X、Y、Z六种原子序数依次增大前20号元素,其中U和X,W和Y分别在同一主族,Y、W的原子序数相差8,Y的原子序数是W的原子序数两倍知,所以Y是硫元素,W是氧元素;Z的原子序数是U和X的原子序数之和,U和X在同一主族,且U、X、Z的原子序数不大于20,若U、X的原子序数相差2,不符合题意;所以若U、X的原子序数相差8,设U的原子序数为a,a+a+8≤20,所以a≤6,且Z的原子序数大于16,所以a为6,故U为碳元素,X为硅元素,Z为钙元素;U、V、W三种原子序数依次增大,U为碳元素,W是氧元素,所以V是氮元素.
(1)根据U、V组成的阴离子(U、V都满足8电子稳定结构)和Z的阳离子确定形成的化合物,并写出其电子式;
(2)W元素可分别U、Y形成多种常见的阴离子,W和U形成的阴离子有碳酸根离子和碳酸氢根离子,W和Y形成的阴离子有亚硫酸根离子和硫酸根离子,根据实验现象判断含有的离子.
(1)根据U、V组成的阴离子(U、V都满足8电子稳定结构)和Z的阳离子确定形成的化合物,并写出其电子式;
(2)W元素可分别U、Y形成多种常见的阴离子,W和U形成的阴离子有碳酸根离子和碳酸氢根离子,W和Y形成的阴离子有亚硫酸根离子和硫酸根离子,根据实验现象判断含有的离子.
解答:解:(1)通过以上分析知,U、V、W、X、Y、Z分别是碳元素、氮元素、氧元素、硅元素、硫元素、钙元素,U、V组成的阴离子(U、V都满足8电子稳定结构),所以该阴离子是CN-,Z的阳离子是钙离子,所以氢氰根离子和钙离子形成的离子化合物是氰化钙,电子式为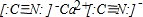 ,
,
故答案为: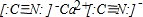 ;
;
(2)W元素可分别U、Y形成多种常见的阴离子,W和U形成的阴离子有碳酸根离子和碳酸氢根离子,W和Y形成的阴离子有亚硫酸根离子和硫酸根离子;
①第一份溶液中加入足量盐酸溶液,只产生无色气体,说明含有弱酸根离子,碳酸根离子、碳酸氢根离子和亚硫酸根离子都是弱酸根离子,所以能和盐酸反应生成无色气体的离子可能是碳酸根离子、硫酸根离子和亚硫酸根离子;
②第二份溶液中加入足量的BaCl2溶液,有白色沉淀产生,再加入足量的稀HNO3,白色沉淀质量减少,能和氯化钡反应生成沉淀的有碳酸根离子、硫酸根离子和亚硫酸根离子,再加入足量的稀HNO3,白色沉淀质量减少,说明含有弱酸根离子,但亚硫酸根离子能被硝酸氧化生成硫酸根离子,所以该溶液中一定含有碳酸根离子,可能含有亚硫酸根离子和硫酸根离子至少有一种.
故答案为:一定含有碳酸根离子,亚硫酸根离子和硫酸根离子至少有一种.
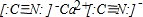 ,
,故答案为:
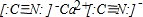 ;
;(2)W元素可分别U、Y形成多种常见的阴离子,W和U形成的阴离子有碳酸根离子和碳酸氢根离子,W和Y形成的阴离子有亚硫酸根离子和硫酸根离子;
①第一份溶液中加入足量盐酸溶液,只产生无色气体,说明含有弱酸根离子,碳酸根离子、碳酸氢根离子和亚硫酸根离子都是弱酸根离子,所以能和盐酸反应生成无色气体的离子可能是碳酸根离子、硫酸根离子和亚硫酸根离子;
②第二份溶液中加入足量的BaCl2溶液,有白色沉淀产生,再加入足量的稀HNO3,白色沉淀质量减少,能和氯化钡反应生成沉淀的有碳酸根离子、硫酸根离子和亚硫酸根离子,再加入足量的稀HNO3,白色沉淀质量减少,说明含有弱酸根离子,但亚硫酸根离子能被硝酸氧化生成硫酸根离子,所以该溶液中一定含有碳酸根离子,可能含有亚硫酸根离子和硫酸根离子至少有一种.
故答案为:一定含有碳酸根离子,亚硫酸根离子和硫酸根离子至少有一种.
点评:本题考查了元素化合物的推断,难度不大,注意硝酸能氧化亚硫酸根离子生成硫酸根离子.

练习册系列答案
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案
相关题目



 有U、V、W、X、Y、Z、T七种前四周期元素,它们的原子序数依次增大,其相关信息如下表:
有U、V、W、X、Y、Z、T七种前四周期元素,它们的原子序数依次增大,其相关信息如下表: