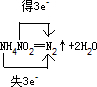摘要:用双线桥法分析下面的方程式 3Br2+6KOH=5KBr+KBrO3+3H2O 3Cu+8HNO32+2NO↑+4H2O
网址:http://m.1010jiajiao.com/timu3_id_175639[举报]
稀硝酸和铜反应的化学方程式如下: 3Cu+8HNO3 =3Cu( NO3 )2+2NO↑+4H2O
(1)用双线桥法分析氧化还原反应(在下面方程式中标出),并指出氧化剂和还原剂。
(2)若生成标准状况下11.2LNO气体,计算参加反应的铜的质量以及反应中被还原的HNO3的物质的量。
查看习题详情和答案>>
(1)用双线桥法分析氧化还原反应(在下面方程式中标出),并指出氧化剂和还原剂。
(2)若生成标准状况下11.2LNO气体,计算参加反应的铜的质量以及反应中被还原的HNO3的物质的量。
已知铜在常温下能被稀硝酸溶解,其反应的化学方程式如下:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
(1)用双线桥法分析上述反应(只需标出电子得失的方向和数目)

 ;
;
(2)硝酸没有全部参加氧化还原反应,没有参加氧化还原反应的硝酸占总硝酸的
;
(3)标况下生成3.36L NO,被还原的硝酸的物质的量为
查看习题详情和答案>>
(1)用双线桥法分析上述反应(只需标出电子得失的方向和数目)


(2)硝酸没有全部参加氧化还原反应,没有参加氧化还原反应的硝酸占总硝酸的
| 3 |
| 4 |
| 3 |
| 4 |
(3)标况下生成3.36L NO,被还原的硝酸的物质的量为
0.15mol
0.15mol
;若反应中转移了0.6mol电子,产生的气体在标准状况下的体积是4.48L
4.48L
.已知铜在常温下能被稀硝酸溶解,其反应的化学方程式如下
3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O
(1)用双线桥法分析上述反应(只需标出电子得失的方向和数目)
(2)上述反应中氧化剂是
(3)当生成0.5mol的 NO时,反应转移电子是
查看习题详情和答案>>
3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O
(1)用双线桥法分析上述反应(只需标出电子得失的方向和数目)
(2)上述反应中氧化剂是
HNO3
HNO3
,氧化产物是Cu(NO3)2
Cu(NO3)2
.(3)当生成0.5mol的 NO时,反应转移电子是
1.5
1.5
mol,同时还原的硝酸为31.5
31.5
克.在2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O反应中
(1)
(2)该反应的离子方程式为:
(3)用双线桥法分析此氧化还原反应 2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O

(4)NA表示阿伏伽德罗常数,若产生标准状况下的气体的体积为2.24L,则反应过程中转移电子的数目为
查看习题详情和答案>>
(1)
HCl
HCl
是还原剂,MnCl2
MnCl2
是还原产物.(2)该反应的离子方程式为:
MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O
MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O
.(3)用双线桥法分析此氧化还原反应 2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O


(4)NA表示阿伏伽德罗常数,若产生标准状况下的气体的体积为2.24L,则反应过程中转移电子的数目为
0.2NA
0.2NA
,被氧化的HCl的质量为7.3
7.3
g.