题目内容
金属加工后的废弃液中含2%~5%的NaNO2,它是一种环境污染物.人们用NH4Cl溶液来处理此废弃液,使 NaNO2溶液转化为无毒物质.该反应分两步进行.第一步:NaNO2+NH4Cl═NaCl+NH4NO2,第二步:NH4NO2═N2↑+2H2O.
①第一步属于
②在上述氧化还原反应中,
③用双线桥法分析上述氧化还原反应: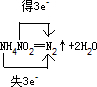
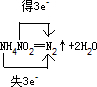 .
.
①第一步属于
复分解
复分解
反应,第二步属于分解
分解
反应.(填基本反应类型)②在上述氧化还原反应中,
NH4NO2
NH4NO2
被氧化,NH4NO2
NH4NO2
被还原;NH4NO2
NH4NO2
是氧化剂,N2
N2
是氧化产物.③用双线桥法分析上述氧化还原反应:
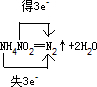
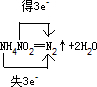
分析:①根据反应物和生成物的种类和多少来分析四种基本反应类型;
②根据元素的化合价变化来分析氧化还原反应,含元素化合价降低的物质为氧化剂,被还原;含元素化合价升高的物质为还原剂,被氧化,对应的产物为氧化产物;
③元素的化合价降低,得电子,元素的化合价升高的失去电子,以此来用双线桥法表示氧化还原反应中转移的电子数目和方向.
②根据元素的化合价变化来分析氧化还原反应,含元素化合价降低的物质为氧化剂,被还原;含元素化合价升高的物质为还原剂,被氧化,对应的产物为氧化产物;
③元素的化合价降低,得电子,元素的化合价升高的失去电子,以此来用双线桥法表示氧化还原反应中转移的电子数目和方向.
解答:解:①第一步反应为NaNO2+NH4Cl═NaCl+NH4NO2,是化合物与化合物相互交换成分生成两种新的化合物,则属于复分解反应,第二步反应为NH4NO2═N2↑+2H2O,是一种物质分解生成两种物质,则属于分解反应,故答案为:复分解;分解;
②反应NH4NO2═N2↑+2H2O中N元素的化合价由-3价升高到0,N元素的化合价由+5价降低为0,属于氧化还原反应,NH4NO2既是氧化剂又是还原剂,在反应中既被氧化又被还原,而氮气既是氧化产物又是还原产物,故答案为:NH4NO2;NH4NO2;NH4NO2;N2;
③由NH4NO2═N2↑+2H2O中N元素的化合价由-3价升高到0,N元素的化合价由+5价降低为0,则双线桥法表示氧化还原反应中转移的电子数目和方向为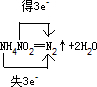 ,
,
故答案为: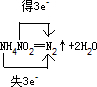 .
.
②反应NH4NO2═N2↑+2H2O中N元素的化合价由-3价升高到0,N元素的化合价由+5价降低为0,属于氧化还原反应,NH4NO2既是氧化剂又是还原剂,在反应中既被氧化又被还原,而氮气既是氧化产物又是还原产物,故答案为:NH4NO2;NH4NO2;NH4NO2;N2;
③由NH4NO2═N2↑+2H2O中N元素的化合价由-3价升高到0,N元素的化合价由+5价降低为0,则双线桥法表示氧化还原反应中转移的电子数目和方向为
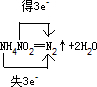 ,
,故答案为:
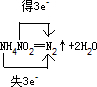 .
.点评:本题以信息的形式考查反应类型,明确反应的分类依据及氧化还原反应中元素的化合价变化是解答本题的关键,难度不大,注重了基础.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
