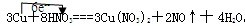题目内容
已知铜在常温下能被稀硝酸溶解,其反应的化学方程式如下
3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O
(1)用双线桥法分析上述反应(只需标出电子得失的方向和数目)
(2)上述反应中氧化剂是
(3)当生成0.5mol的 NO时,反应转移电子是
3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O
(1)用双线桥法分析上述反应(只需标出电子得失的方向和数目)
(2)上述反应中氧化剂是
HNO3
HNO3
,氧化产物是Cu(NO3)2
Cu(NO3)2
.(3)当生成0.5mol的 NO时,反应转移电子是
1.5
1.5
mol,同时还原的硝酸为31.5
31.5
克.分析:(1)根据Cu元素的化合价变化、N元素的化合价变化来分析,化合价升高的元素原子失去电子,化合价降低的元素的原子得到电子,化合价升高值=化合价降低值=转移电子数;
(2)含元素化合价降低的物质为氧化剂,含元素化合价升高的物质为还原剂,还原剂对应的产物为氧化产物;
(3)生成硝酸盐体现硝酸的酸性,生成NO体现硝酸的氧化性,当生成2molNO转移的电子为6mol,结合化学方程式来计算.
(2)含元素化合价降低的物质为氧化剂,含元素化合价升高的物质为还原剂,还原剂对应的产物为氧化产物;
(3)生成硝酸盐体现硝酸的酸性,生成NO体现硝酸的氧化性,当生成2molNO转移的电子为6mol,结合化学方程式来计算.
解答:解:(1)解:(1)在反应3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O中,Cu元素的化合价由0升高到+2价,N元素的化合价由+5降低为+2价,转移的电子为6e-,则双线桥法标出电子得失的方向和数目为 ,故答案为:
,故答案为: ;
;
(2)N元素的化合价降低,Cu元素的化合价升高,则硝酸为氧化剂,硝酸铜为氧化产物,
故答案为:HNO3,Cu(NO3)2;
(3)根据化学方程式,当生成2molNO时,转移的电子为6mol,消耗硝酸8mol,在8mol硝酸中,只有2mol硝酸被还原,即被还原的硝酸是参加反应硝酸的量的
,所以当生成0.5mol的NO时,反应转移电子是1.5mol,消耗硝2mol,被还原的硝酸是0.5mol,质量是0.5mol×63g/mol=31.5g,故答案为:1.5,31.5.
 ,故答案为:
,故答案为: ;
;(2)N元素的化合价降低,Cu元素的化合价升高,则硝酸为氧化剂,硝酸铜为氧化产物,
故答案为:HNO3,Cu(NO3)2;
(3)根据化学方程式,当生成2molNO时,转移的电子为6mol,消耗硝酸8mol,在8mol硝酸中,只有2mol硝酸被还原,即被还原的硝酸是参加反应硝酸的量的
| 1 |
| 4 |
点评:本题考查氧化还原反应,明确元素的化合价变化及原子守恒的方法来分析是解答本题的关键,并注意反应中化学计量数与转移电子数目的关系来解答即可.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目