网址:http://m.1010jiajiao.com/timu3_id_175594[举报]
| 时间(S)浓度 | 0 | 20 | 40 | 60 | 80 | 100 |
| c(A)mol?L-1 | 0.100 | 0.070 | 0.050 | c3 | a | b |
| c(B)mol?L-1 | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
(1)该反应的化学方程式为______,表中c2______c3、a______b(填>、<、=),若在相同情况下最初向该容器充入的是B气体,要达到上述同样的平衡状态,B的起始浓度是______mol?L-1.
(2)在体积为l L的密闭容器中,充入lmol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化如图所示.
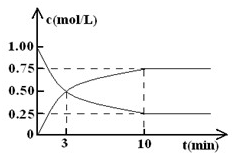
(I)从反应开始到平衡,甲醇的平均反应速率v(CH3OH)=______;
该反应的平衡常数k=______.
(II)乙醇是重要的化工产品和液体燃料,同样可以利用CO2反应制取乙醇:
2CO2(g)+6H2(g)
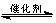
CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011
在一定压强下,测得反应的实验数据如下表.分析表中数据回答下列问题:
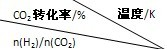 |
500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
②提高氢碳比[n(H2)/n(CO2)],K值______(填“增大”、“减小”、或“不变”).
(1)实验室中可用下图A或B装置与相应的药品制得丙.
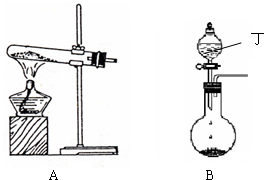
①A中试管内反应的化学方程式是
| ||
| ||
②B中分液漏斗内盛放的物质丁是
(2)工业上将甲和乙在高温、高压、催化剂的条件下制取丙.下图是甲和乙反应过程中能量变化图:
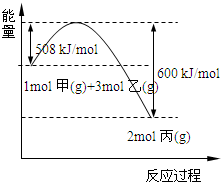
该反应的热化学方程式是
(3)丙在氧气中燃烧的反应是置换反应,该反应的化学方程式是
| ||
| ||
(4)①将丙和CO2气体通入饱和食盐水中有碳酸氢钠晶体析出,反应的离子方程式是
②为了验证上述晶体既不是NH4HCO3、也不是NaCl而是NaHCO3,设计实验方案如下,完成下列部分实验报告:
| 实验操作 | 实验现象 | 结论 | 相应的离子方程式 |
| 取少量晶体于试管中,充分加热 | 试管内有固体剩余 | 该晶体不是NH4HCO3 该晶体不是NH4HCO3 |
无离子方程式 无离子方程式 |
向冷却后试管中加入足量盐酸 向冷却后试管中加入足量盐酸 |
固体全部溶解,有气泡产生 | 该晶体不是NaCl是NaHCO3 该晶体不是NaCl是NaHCO3 |
CO32-+2H+=H2O+CO2↑ CO32-+2H+=H2O+CO2↑ |
(16分)碳及其化合物与人类生产、生活密切相关。请回答下列问题:
(1)在化工生产过程中,少量CO的存在会引起催化剂中毒。为了防止催化剂中毒,常用SO2将CO氧化SO2被还原为S。
已知: C(s)+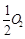 (g)=CO(g)ΔH1=-126.4kJ/mol ①
(g)=CO(g)ΔH1=-126.4kJ/mol ①
C(s)+O2(g)=CO2(g) ΔH2= -393.5kJ·mol-1 ②
S(s)+O2(g)=SO2(g) ΔH3= -296.8kJ·mol-1 ③
则SO2氧化CO的热化学反应方程式:
(2)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。
CH3OH(g)。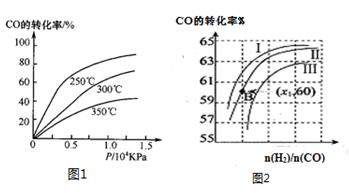
①CO在不同温度下的平衡转化率与压强的关系如图1所示,该反应ΔH 0(填“>”或“ <”)。
图2表示CO的转化率与起始投料比[ n(H2)/n(CO)]、温度的变化关系,曲线I、II、III对应的平衡常数分别为K1、K2、K3,则K1、K2、K3的大小关系为 ;测得B(X1,60)点氢气的转化率为40%,则x1= 。
②在恒容密闭容器里按体积比为1:2充入一氧化碳和氢气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向正反应方向移动的是 (填序号)。
| A.正反应速率先增大后减小 | B.逆反应速率先增大后减小 |
| C.化学平衡常数K值增大 | D.反应物的体积百分含量增大 |
③一定条件下,将2molCO和2molH2置于容积为2L固定的密闭容器中发生上述反应,反应达到平衡时CO与H2体积之比为2∶1,则平衡常数K= 。
(3)最新研究发现,用隔膜电解法可以处理高浓度乙醛废水。
原理:使用惰性电极电解,乙醛分别在阴、阳极转化为乙醇和乙酸,
总反应为:2CH3CHO+H2O
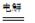 CH3CHOH+CH3CHOOH。
CH3CHOH+CH3CHOOH。实验室中,以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的 处理过程,其装置示意图如图所示:
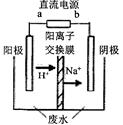
①电解过程中,两极除分别生成乙酸和乙醇外,均产生无色气体,阳极电极反应分别为:
4OH--4e-═O2↑+2H2O; 。
②在实际工艺处理过程中,阴极区乙醛的去除率可达60%。若在两极区分别注入1m3乙醛的含量为300mg/L的废水,可得到乙醇 kg(计算结果保留2位小数) 查看习题详情和答案>>
(1)在化工生产过程中,少量CO的存在会引起催化剂中毒。为了防止催化剂中毒,常用SO2将CO氧化SO2被还原为S。
已知: C(s)+
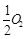 (g)=CO(g)ΔH1=-126.4kJ/mol ①
(g)=CO(g)ΔH1=-126.4kJ/mol ①C(s)+O2(g)=CO2(g) ΔH2= -393.5kJ·mol-1 ②
S(s)+O2(g)=SO2(g) ΔH3= -296.8kJ·mol-1 ③
则SO2氧化CO的热化学反应方程式:
(2)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)
 CH3OH(g)。
CH3OH(g)。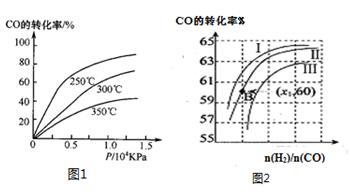
①CO在不同温度下的平衡转化率与压强的关系如图1所示,该反应ΔH 0(填“>”或“ <”)。
图2表示CO的转化率与起始投料比[ n(H2)/n(CO)]、温度的变化关系,曲线I、II、III对应的平衡常数分别为K1、K2、K3,则K1、K2、K3的大小关系为 ;测得B(X1,60)点氢气的转化率为40%,则x1= 。
②在恒容密闭容器里按体积比为1:2充入一氧化碳和氢气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向正反应方向移动的是 (填序号)。
| A.正反应速率先增大后减小 | B.逆反应速率先增大后减小 |
| C.化学平衡常数K值增大 | D.反应物的体积百分含量增大 |
③一定条件下,将2molCO和2molH2置于容积为2L固定的密闭容器中发生上述反应,反应达到平衡时CO与H2体积之比为2∶1,则平衡常数K= 。
(3)最新研究发现,用隔膜电解法可以处理高浓度乙醛废水。
原理:使用惰性电极电解,乙醛分别在阴、阳极转化为乙醇和乙酸,
总反应为:2CH3CHO+H2O
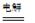 CH3CHOH+CH3CHOOH。
CH3CHOH+CH3CHOOH。实验室中,以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的 处理过程,其装置示意图如图所示:

①电解过程中,两极除分别生成乙酸和乙醇外,均产生无色气体,阳极电极反应分别为:
4OH--4e-═O2↑+2H2O; 。
②在实际工艺处理过程中,阴极区乙醛的去除率可达60%。若在两极区分别注入1m3乙醛的含量为300mg/L的废水,可得到乙醇 kg(计算结果保留2位小数)
(14分)煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(1) 将水蒸气通过红热的碳即可产生水煤气。反应为:
![]()
一定温度下,在一个容积固定的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是 (填字母)。
a.容器中的压强不变 b.1 mol H-H键断裂的同时断裂2 mol H-O键
c. ![]() =(CO)=
=(CO)=![]() (H2O) d.c(CO)=c(H2)
(H2O) d.c(CO)=c(H2)
(2) 将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中,进行反应
![]() ,得到如下三组数据:
,得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
|
|
|
| |||
1 | 650 | 2 | 4 | 1.6 | 1.6 | 5 |
2 | 900 | 1 | 2 | 0.4 | 0.4 | 3 |
3 | 9.. | a | b | c | d | t |
①实验l中以![]() (CO2)表示的反应速率为 。
(CO2)表示的反应速率为 。
②该反应的逆反应为 (填“吸”或“放’’)热反应
③若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),且t<3min,则a、b应满足的关系是 (用含a、b的数学式表示)。
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:

![]() 右图表示
右图表示
该反应进行过程中能量(单位为lkJ?mol。)的变化。
①在体积为1 L的恒容密闭容器中,充入l molCO2和3molH2,下列措施中能使c(CH3OH)增大的是 (填字母)
a.升高温度
b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来
 d.再充入l mol CO2和3 molH2
d.再充入l mol CO2和3 molH2
②当反应达到平衡时不断改变条件(但不改变各组分物质的量和状态)反应速率随时间的变化如右图:其中表示平衡混合物中CH3OH含量最高的一段时间是 ;如t0~t1平衡常数为.K1,t2~t3平衡常数为K2,则K1 K2(填“大于”、“等于”或“小于”)。
查看习题详情和答案>>