摘要:C 解析:,.故P单质既被氧化又被还原. 点评:元素化合价的变化是氧化还原反应的特征.所以此题通过分析P的化合价的前后变化来判断.
网址:http://m.1010jiajiao.com/timu3_id_175261[举报]
(2008?上海)四种短周期元素的性质或结构信息如下表.请根据信息回答下列问题.
(1)B元素在周期表中的位置
(2)写出C单质与水反应的化学方程式
(3)D元素最高价氧化物晶体的硬度
(4)A、B两元素非金属性较强的是(写元素符号)
查看习题详情和答案>>
| 元素 | A | B | C | D |
| 性质 结构 信息 |
室温下单质呈粉末状固体,加热易熔化. 单质在氧气中燃烧,发出明亮的蓝紫色火焰. |
单质常温、常压下是气体,能溶于水. 原子的M层有1个未成对的p电子. |
单质质软、银白色固体、导电性强. 单质在空气中燃烧发出黄色的火焰. |
原子最外层电子层上s电子数等于p电子数. 单质为空间网状晶体,具有很高的熔、沸点. |
第三周期ⅦA
第三周期ⅦA
,写出A原子的电子排布式1s22s22p63s23p4
1s22s22p63s23p4
.(2)写出C单质与水反应的化学方程式
2Na+2H2O=2NaOH+H2↑
2Na+2H2O=2NaOH+H2↑
.A与C形成的化合物溶于水后,溶液的pH>
>
7(填“大于”、“等于”或“小于”).(3)D元素最高价氧化物晶体的硬度
小(或大)
小(或大)
(填“大”、“小”),其理由是二氧化碳是分子晶体(或二氧化硅是原子晶体)
二氧化碳是分子晶体(或二氧化硅是原子晶体)
.(4)A、B两元素非金属性较强的是(写元素符号)
Cl
Cl
.写出证明这一结论的一个实验事实高氯酸的酸性大于硫酸的酸性或氯化氢稳定比硫化氢强
高氯酸的酸性大于硫酸的酸性或氯化氢稳定比硫化氢强
.四种短周期元素的性质或结构信息如下表,请根据信息回答下列问题.
(1)B元素在周期表中的位置
(2)写出C单质与水反应的化学的化学方程式
(3)写出D元素的最高价氧化物与氢氧化钠溶液反应的离子方程式
(4)A、B两元素非金属性较强的是(写元素符号)
查看习题详情和答案>>
| 元素 | A | B | C | D |
| 性质 结构 信息 |
室温下单质是粉末状固体,加热易熔化. 单质在空气中燃烧生成的气体是形成酸雨的主要污染物之一. |
单质常温、常压下是黄绿色气体,能溶于水. | 单质质软、银白色固体、导电性强. 单质在空气中燃烧发出黄色的火焰. |
原子最外层电子层上s电子数等于p电子数. 单质是一种常见的半导体材料. |
第三周期第ⅦA族
第三周期第ⅦA族
,写出A原子的电子排布式1s22s22p63s23p4
1s22s22p63s23p4
.(2)写出C单质与水反应的化学的化学方程式
2Na+2H2O═2NaOH+H2↑
2Na+2H2O═2NaOH+H2↑
.A与C形成的化合物溶于水后,溶液的pH大于
大于
7(填“大于”、“等于”或“小于”)(3)写出D元素的最高价氧化物与氢氧化钠溶液反应的离子方程式
SiO2+2OH-═SiO32-+H2O
SiO2+2OH-═SiO32-+H2O
.(4)A、B两元素非金属性较强的是(写元素符号)
Cl
Cl
.写出证明这一结论的一个实验事实高氯酸的酸性强于硫酸的酸性或氯化氢的稳定性强于硫化氢或氯气氧化硫化氢为硫单质
高氯酸的酸性强于硫酸的酸性或氯化氢的稳定性强于硫化氢或氯气氧化硫化氢为硫单质
.有A、B、C、D四种短周期的主族元素,它们的原子序数依次增大,其中A元素原子核外电子仅占据一种原子轨道,也是宇宙中最丰富的元素,B元素原子的核外p轨道电子数比s轨道电子数少1,C为金属元素且原子核外p轨道电子数和s轨道电子数相等;D元素的原子核外所有p轨道全满或半满.
(1)写出四种元素的元素符号:A
(2)写出D元素基态原子的外围电子排布式:
(3)写出B、C两种元素的单质在一定条件下反应的化学方程式
(4)写出C元素形成的氯化物的电子式:
 .
.
查看习题详情和答案>>
(1)写出四种元素的元素符号:A
H
H
;BN
N
;CMg
Mg
;DP
P
.(2)写出D元素基态原子的外围电子排布式:
3s23p3
3s23p3
;(3)写出B、C两种元素的单质在一定条件下反应的化学方程式
3Mg+N2
Mg3N2
| ||
3Mg+N2
Mg3N2
.
| ||
(4)写出C元素形成的氯化物的电子式:


(2010?辽宁二模)A、B、C、D、E五种单质均由短周期元素组成,在化学反应中均能形成简单的阳离子或阴离子,且B、D、E离子具有相同的电子层结构,离子半径CBDEA.常温时,A、B为气态,A和B两元素可形成2:1或1:1的共价化合物M或N.它们之间的部分转化关系如下:其中F、P和E的最高价氧化物的水化物都具有相同的摩尔质量.

请回答下列问题:
(1)E的原子结构示意图为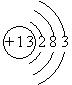
 ,F的电子式是
,F的电子式是
 ;
;
(2)以铂作电极,Q为电解质溶液,通入A、B单质形成原电池,通入气体A的电极是
(3)N与P的化学性质具有一定的相似性,其最典型的共性是
(4)写出E与Q溶液反应的离子方程式,并指出电子转移的方向和数目
 .
.
(5)已知:4D(s)+B(g)=2G(s)△H=-akJ?mol--12D(s)+B(g)=P(s)△H=-bkJ?mol-1用化学式表示B与G反应生成P的热化学方程式
查看习题详情和答案>>

请回答下列问题:
(1)E的原子结构示意图为




(2)以铂作电极,Q为电解质溶液,通入A、B单质形成原电池,通入气体A的电极是
负
负
极,正极的电极反应式为2H2O+O2+4e-═4OH-
2H2O+O2+4e-═4OH-
.(3)N与P的化学性质具有一定的相似性,其最典型的共性是
强氧化性
强氧化性
.(4)写出E与Q溶液反应的离子方程式,并指出电子转移的方向和数目


(5)已知:4D(s)+B(g)=2G(s)△H=-akJ?mol--12D(s)+B(g)=P(s)△H=-bkJ?mol-1用化学式表示B与G反应生成P的热化学方程式
2Na2O(s)+O2(g)2=Na2O2(s)△H=(a-2b)kJ/mol
2Na2O(s)+O2(g)2=Na2O2(s)△H=(a-2b)kJ/mol
.已知B、C为常见的两种金属单质,E、I为常见的两种非金属单质,A为硫酸盐反应②为D的溶液与C在加热条件下的反应,P溶液和G溶液中具有相同的阳离子,请根据要求回答下列问题.

(1)B元素在周期表的位置:
(2)物质I的电子式:
 .
.
(3)Y转变为X的现象是:
(4)写出反应④的化学反应方程式:
(5)向沸水中加入H的饱和溶液,可得到红褐色溶液,其溶液所具有性质
A.具有丁达尔效应
B.处加直流电源阳极附近溶液颜色加深
C.加入盐酸溶液出现先沉淀后溶解的现象
D.能透过半透膜,不能透过滤纸
(6)向含1molG的溶液中加入1molNa2O2,所发生的离子反应方程式:
查看习题详情和答案>>

(1)B元素在周期表的位置:
第四周期第ⅤⅢ族
第四周期第ⅤⅢ族
,(2)物质I的电子式:


(3)Y转变为X的现象是:
白色絮状沉淀迅速变为灰绿色,最终转化为红褐色
白色絮状沉淀迅速变为灰绿色,最终转化为红褐色
.涉及的反应方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3
4Fe(OH)2+O2+2H2O=4Fe(OH)3
.(4)写出反应④的化学反应方程式:
Fe3O4+8HCl=FeCl2+2FeCl3+4H2O
Fe3O4+8HCl=FeCl2+2FeCl3+4H2O
.物质F与HI水溶液的离子反应方程式 式:Fe3O4+2I-+8H+=I2+3Fe2++4H2O
Fe3O4+2I-+8H+=I2+3Fe2++4H2O
.(5)向沸水中加入H的饱和溶液,可得到红褐色溶液,其溶液所具有性质
AC
AC
.A.具有丁达尔效应
B.处加直流电源阳极附近溶液颜色加深
C.加入盐酸溶液出现先沉淀后溶解的现象
D.能透过半透膜,不能透过滤纸
(6)向含1molG的溶液中加入1molNa2O2,所发生的离子反应方程式:
4Fe 2++4Na2O2+6H2O═4Fe(OH)3↓+8Na++O2↑
4Fe 2++4Na2O2+6H2O═4Fe(OH)3↓+8Na++O2↑
.