网址:http://m.1010jiajiao.com/timu3_id_175211[举报]
硫酸铜是一种应用极其广泛的化工原料。铜不能与稀硫酸直接反应,本实验中将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图1、2所示)。
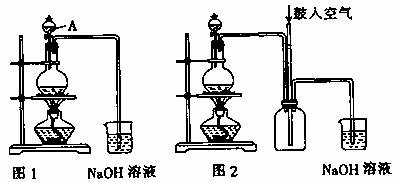
(1)图1烧瓶中发生的反应的离子反应方程式为: 。
(2)图2是图1的改进装置,其优点有:
① ;
② 。
(3)为符合绿色化学的要求,某研究性学习小组进行如下设计:
第一组:以空气为氧化剂法
方案1:以空气为氧化剂。将铜粉在仪器B中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应。
方案2:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加FeSO4或Fe2(SO4)3,即发生反应。反应完全后向其中加物质甲调节pH到3―4,产生Fe(OH)3沉淀,过滤、蒸发、结晶,滤渣作催化剂循环使用。(已知Fe(OH)3和Cu(OH)2完全沉淀时的pH分别为3.7、6.4。)
请回答下列问题:
①方案1中的B仪器名称是 。
②方案2中甲物质是 (填字母序号)。
a、CaO b、CuCO3 c、CaCO3
第二组:过氧化氢为氧化剂法
将3.2g铜丝放到45 mL 1.5mol?L-1的稀硫酸中,控温在50℃。加入18mL 10%的H2O2,反应0.5h后,升温到60℃,持续反应1 h后,过滤、蒸发结晶、减压抽滤等,用少量95%的酒精淋洗后晾干,得CuSO4?5H2O 10.6g。
请回答下列问题:
③加热时温度不宜过高的原因是 ,晶体采用酒精淋洗的优点是 。
④上述两种氧化法中,更符合绿色化学理念的是 (填“第一组”或“第二组”),理由是 、
、 。
查看习题详情和答案>>硫酸铜是一种应用极其广泛的化工原料。铜不能与稀硫酸直接反应,本实验中将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图1、2所示)

(1)图1烧瓶中发生的离子反应方程式为: 。
(2)图2是图1的改进装置,其优点有: 。
(3)为符合绿色化学的要求,某研究性学习小组进行如下设计:
第一组:以空气为氧化剂法
方案1:以空气为氧化剂。将铜粉在仪器B中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应。
方案2:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加FeSO4或Fe2(SO4)2,即发生反应。反应完全后向其中加物质甲调节pH到3~4,产生Fe(OH)3沉淀,过滤、蒸发、结晶,滤渣作催化剂循环使用。
(已知Fe(OH)3和Cu(OH)2完全沉淀时的pH分别为3.7、6.4。)
请回答下列问题:①方案中的B仪器名称是 。
②方案2中甲物质是 (填字母序号)。
a.CaO b.CuCO3 c.CaCO3
第二组:过氧化氢为氧化剂法
将3.2g铜丝放到45ml 1.5mol?L―1的稀硫酸中,控温在50℃。加入18mL 10%的H2O2,反应0.5h后,升温到60℃,持续反应1h后,过滤、蒸发结晶、减压抽滤等,用少量95%的酒精淋洗后晾干,得到CuSO4?5H2O的质量为10.6g。
请回答下列问题:
③加热时温度不宜过高的原因是 ,根据有关数据计算出制取CuSO4?5H2O的产率(实际产量与理论产量的百分比)= 。
查看习题详情和答案>>硫酸铜是一种应用极其广泛的化工原料.铜不能与稀硫酸直接反应,本实验中将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发.结晶得到硫酸铜晶体(装置如图1、2所示).

(1)图1中A仪器的名称________,烧瓶中发生的离子反应方程式为:________
(2)图2是图1的改进装置,其优点有:
①________________;②________________.
(3)为符合绿色化学的要求,某研究性学习小组进行如下设计:
第一组:以空气为氧化剂法
方案1:以空气为氧化剂.将铜粉在仪器B中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应.
方案2:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应.向反应液中加FeSO4或Fe2(SO4)3,即发生反应.反应完全后向其中加物质甲调节pH到3~4,产生Fe(OH)3沉淀,过滤、蒸发、结晶,滤渣作催化剂循环使用.(已知Fe(OH)3和Cu(OH)2完全沉淀时的pH分别为3、7、6、4.)
请回答下列问题:
①方案1中的B仪器名称是________.
②方案2中甲物质是________(填字母序号).
a.CaO b.CuCO3 c.CaCO3 d.NH3·H2O
第二组:过氧化氢为氧化剂法
将3.2 g铜丝放到45 mL 1.5 mol/L的稀硫酸中,控温在50℃.加入18 mL 10%的H2O2,反应0.5小时后,升温到60℃,持续反应1小时后,过滤、蒸发结晶、减压抽滤等,用少量95%的酒精淋洗后晾干,得CuSO4·5H2O 10.6 g.
请回答下列问题:
③加热时温度不宜过高的原因是________________,晶体采用酒精淋洗的优点是________________.
④上述两种氧化法中,更符合绿色化学理念的是________(填“第一组”或“第二组”),理由是_________、_________、_________.
(08黄冈市模拟)(15分)硫酸铜是一种应用极其广泛的化工原料。铜不能与稀硫酸直接反应,本实验中将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图1、2所示)
|
(1)图1烧瓶中发生的离子反应方程式为: 。
(2)图2是图1的改进装置,其优点有: 。
(3)为符合绿色化学的要求,某研究性学习小组进行如下设计:
第一组:以空气为氧化剂法
方案1:以空气为氧化剂。将铜粉在仪器B中反复灼烧,使铜与空气充分反应生成氧化铜,再将氧化铜与稀硫酸反应。
方案2:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加FeSO4或Fe2(SO4)2,即发生反应。反应完全后向其中加物质甲调节pH到3~4,产生Fe(OH)3沉淀,过滤、蒸发、结晶,滤渣作催化剂循环使用。
(已知Fe(OH)3和Cu(OH)2完全沉淀时的pH分别为3.7、6.4。)
请回答下列问题:①方案中的B仪器名称是 。
②方案2中甲物质是 (填字母序号)。
a.CaO b.CuCO3 c.CaCO3
第二组:过氧化氢为氧化剂法
将3.2g铜丝放到45ml 1.5mol?L―1的稀硫酸中,控温在50℃。加入18mL 10%的H2O2,反应0.5h后,升温到 60℃,持续反应1h后,过滤、蒸发结晶、减压抽滤等,用少量95%的酒精淋洗后晾干,得到CuSO4?5H2O的质量为10.6g。
请回答下列问题:
③加热时温度不宜过高的原因是 ,根据有关数据计算出制取
CuSO4?5H2O的产率(实际产量与理论产量的百分比)= 。
查看习题详情和答案>>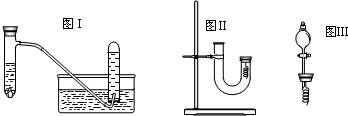
(1)写出试管内溶液中发生反应的化学方程式
(2)在实验过程中观察到试管内的溶液呈
(3)乙同学认为甲虽然收集到的气体是一氧化氮,但并不能说明反应中一定生成一氧化氮.他的理由是
有关化学方程式为:
(4)丙同学釆用如图Ⅱ所示装置进行实验,证明了铜与稀硝酸反应生成一氧化氮.该同学的步骤如下表所示,请回答实验中的有关问题.
| 实验步骤 | 问题 |
| 1从U型管左端加入稀硝酸直至充满U型管右端 | ∥/ |
| 2用附有铜丝的胶塞塞住U型管右端,观察现象 | 现象是 有无色气体产生,右边溶液逐渐变成绿色 有无色气体产生,右边溶液逐渐变成绿色 |
| 3待反应停止后打开胶塞,观察实验现象 | 现象是 无色气体与空气接触后立即变成红棕色 无色气体与空气接触后立即变成红棕色 |
(6)丁同学用图Ⅲ所示装置代替图Ⅱ中U型管右端的附有铜丝的胶塞进行实验,待反应停止后将一氧化氮气体排入分液漏斗中,观察到的实验现象与丙同学实验的第
(7)实验结束后丁同学向分液漏斗中注入适量水并充分振荡,试写出发生的化学反应方程式
(8)若将32.64g铜与140mL一定浓度的硝酸反应,铜完全溶解,产生的NO和NO2混合气体在标准状况下的体积为11.2L(不考虑NO2的反应),试回答:
①若铜与硝刚好反应完全,则原硝酸溶液的物质的量浓度为
②将产生的气体全部释放后,向溶液中加入VmL amol?L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化为沉淀,则原硝酸溶液的物质的量浓度为
| 10-3a﹒V +0.5 |
| 0.14 |
| 10-3a﹒V +0.5 |
| 0.14 |
③已知NO和NO2的混合气与足量氧气混合后能被水完全吸收成硝酸,则要使上述11.2L气体完全被水吸收成硝酸,理论上需消耗标准状况下的氧气
3Cu+8HNO3=3Cu(NO3 ) 2+2NO↑+4H2O
3 2
1.5xmol xmol
Cu+4HNO3(浓)=Cu(NO3 ) 2+2NO2↑+2H2O
1 2
| 1 |
| 2 |
所以方程组为
|
所以
|
即一氧化氮为0.26mol,二氧化氮为0.24mol.
4NO+2H2O+3O2=4HNO3
4 3
0.26mol 0.195mol
4 NO2+2H2O+O2=4HNO3
41
0.24mol 0.06mol
所以需要氧气0.195mol+0.06mol=0.255mol,体积为0.255mol×22.4L/mol=5.71L
3Cu+8HNO3=3Cu(NO3 ) 2+2NO↑+4H2O
3 2
1.5xmol xmol
Cu+4HNO3(浓)=Cu(NO3 ) 2+2NO2↑+2H2O
1 2
| 1 |
| 2 |
所以方程组为
|
所以
|
即一氧化氮为0.26mol,二氧化氮为0.24mol.
4NO+2H2O+3O2=4HNO3
4 3
0.26mol 0.195mol
4 NO2+2H2O+O2=4HNO3
41
0.24mol 0.06mol
所以需要氧气0.195mol+0.06mol=0.255mol,体积为0.255mol×22.4L/mol=5.71L
