摘要:24.将8.4gNaHCO3和7.8gNa2O2在密闭容器中灼烧.充分反应后.容器内的物质是( ) A.Na2CO3.Na2O和O2 B.Na2CO3.O2和H2O(g) C.Na2CO3.CO2.O2和H2O(g) D.Na2CO3.NaOH和O2 密 封 线 第II卷 非选择题
网址:http://m.1010jiajiao.com/timu3_id_174254[举报]
t℃时,将3mol A 和1mol B气体,通入体积为2L的密闭容器(容积不变),发生反应:3A(g)+B(g)?4C(g) 2min时反应达到平衡状态(温度不变),并测得C 的浓度为0.4mol/L,请填写下列空白:
(1)从反应开始到达到平衡状态,生成C的平均反应速率为
(2)达到平衡状态时,B 物质的转化率α(B)=
(填计算结果).
(3)若继续向原混和物质通入少量氦气后(设氦气不与A、B、C反应),化学平衡
A、向正反应方向移动 B、向逆反应方向移动 C、平衡不移动.
(4)若向原平衡中再充入a mol C,在t℃时达到新平衡,此时B的物质的量为:n (B)=
(5)如果上述反应在相同温度和容器中进行,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入的三种物质的物质的量n(A)、n(B)、n(C)之间该满足的关系为:
查看习题详情和答案>>
(1)从反应开始到达到平衡状态,生成C的平均反应速率为
0.2mol/(L?min)
0.2mol/(L?min)
.(2)达到平衡状态时,B 物质的转化率α(B)=
20%
20%
,平衡常数K=| 1 |
| 27 |
| 1 |
| 27 |
(3)若继续向原混和物质通入少量氦气后(设氦气不与A、B、C反应),化学平衡
C
C
(填字母)A、向正反应方向移动 B、向逆反应方向移动 C、平衡不移动.
(4)若向原平衡中再充入a mol C,在t℃时达到新平衡,此时B的物质的量为:n (B)=
(0.8+0.2a)
(0.8+0.2a)
mol.(5)如果上述反应在相同温度和容器中进行,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入的三种物质的物质的量n(A)、n(B)、n(C)之间该满足的关系为:
n(A)=3n(B),n(C)>0
n(A)=3n(B),n(C)>0
.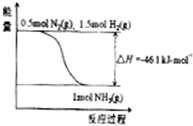 氨在工农业生产中应用广泛.在压强为30MPa时,合成氨平衡混合气体中NH3的体积分数如下:
氨在工农业生产中应用广泛.在压强为30MPa时,合成氨平衡混合气体中NH3的体积分数如下:| 温度/℃ | 200 | 300 | 400 | 500 | 600 |
| 氨含量/% | 89.9 | 71.0 | 47.0 | 26.4 | 13.8 |
(1)根据表中数据,结合化学平衡移动原理,说明合成氨反应是放热反应的原因是
(2)根据图,合成氨的热化学方程式是
(3)在一定温度下,将2mol N2和6mol H2通入到体积为1L的密闭容器中,发生反应N2+3H2?2NH3,2min达到平衡状态时,H2转化率是50%,则用H2表示该反应的平均速率v(H2)=
(4)从化学平衡移动的角度分析,提高H2转化率可以采取的措施是
a.及时分离出NH3 b.升高温度 c.增大压强 d.使用催化剂.
 (2013?临沂三模)工业上“固定”和利用CO2能有效地减轻“温室效应”.
(2013?临沂三模)工业上“固定”和利用CO2能有效地减轻“温室效应”.(1)目前工业上利用CO2来生产燃料甲醇,可将CO2变废为宝.已知常温常压下:
①CH3OH(l)+O2(g)═CO(g)+2H2O(g)△H=-354.8kJ/mol
②2CO(g)+O2(g)═2CO2(g)△H=-566kJ/mol
则反应2CO2(g)+4H2O(g)═2CH3OH(l)+3O2(g)△H=
+1275.6
+1275.6
kJ?mol-1(2)T℃时,已知反应:CO2(g)+H2(g)?CO(g)+H2O(g)△H<0.在T℃下,将2mol CO2和2mol H2充入1L的密闭容器中,测得H2的物质的量随时间的变化情况如图中曲线I所示.
①按曲线I计算反应从0到4min时,υ(H2)=
0.25mol/(L?min)
0.25mol/(L?min)
.②在T℃时,若仅改变某一外界条件时,测得H2的物质的量随时间的变化情况如图中曲线Ⅱ所示,则改变的外界条件为
增大二氧化碳的浓度
增大二氧化碳的浓度
.计算该反应按曲线II进行,达到平衡时,容器中c(CO2)=4.5mol/L
4.5mol/L
.(3)已知25℃时,乙酸和碳酸的电离平衡常数如下表:
| 物质的化学式 | CH3COOH | H2CO3 | |
| 电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 | K2=5.6×10-11 |
碱性
碱性
(填“酸性”、“碱性”或“中性”).②在25℃时,在乙酸溶液中加入一定量的NaHCO3,保持温度不变,所得混合液的pH=6,那么混合液中
| c(CH3COO-) |
| c(CH3COOH) |
18
18
.③向0.1mol?L -1CH3COOH溶液中加入少量CH3COONa晶体,保持温度不变,下列有关说法正确的是
ad
ad
(填代号).a.溶液的pH增大 b.CH3COOH的电离程度增大
c.溶液的导电能力减弱 d.溶液中c(OH-)?c(H+)不变.
常温下,可发生反应:A(g)+B(g)?C(g)+xD(g) 若将2mol A和2mol B 混合充入体积可变的密闭容器中,在不同压强下达到平衡时,C的浓度如下:
|
查看习题详情和答案>>
将1mol CO和1mol H2O(g)充入某固定容积的反应器中,在某条件下达到平衡:
CO+H2O(g)?CO2+H2,此时有
的CO转化为CO2.
(1)该平衡混合物中CO2的物质的量分数为 .
(2)温度不变的条件下向该平衡体系中再充入一定量的氩气,CO的转化率 (填“增大”、“减小”、“不变”)
(3)温度不变的条件下向该平衡体系中再充入1mol CO2和1mol H2,则达新平衡时CO2的物质的量分数为 .
(4)若在相同条件下,开始时向容器中充入1mol CO2、1mol H2和1mol H2O,则达到平衡时,混合物中CO2的物质的量分数可能是下列各值中的 (填编号)
A.16.67%B.22.2%C.33.3%D.36.8%
查看习题详情和答案>>
CO+H2O(g)?CO2+H2,此时有
| 1 | 2 |
(1)该平衡混合物中CO2的物质的量分数为
(2)温度不变的条件下向该平衡体系中再充入一定量的氩气,CO的转化率
(3)温度不变的条件下向该平衡体系中再充入1mol CO2和1mol H2,则达新平衡时CO2的物质的量分数为
(4)若在相同条件下,开始时向容器中充入1mol CO2、1mol H2和1mol H2O,则达到平衡时,混合物中CO2的物质的量分数可能是下列各值中的
A.16.67%B.22.2%C.33.3%D.36.8%