摘要:甲.乙两种单质.A.B.C.D.E.F六种化合物之间可以按下面框图进行反应.已知:C为红褐色沉淀.E为白色沉淀.F焰色反应为黄色. (1)写出甲.乙.B.E化学式: 甲: 乙: B: E: (2)写出①②③反应化学方程式: ① , ② , ③ .
网址:http://m.1010jiajiao.com/timu3_id_173823[举报]
A、B、C、D、E五种元素分属三个短周期,且原子序数依次增大.A、C同主族.A与B、A与C、A与E、B与C可按原子个数比1:1分别形成化合物甲、乙、丙、丁,B、D同主族,可形成DB2、DB3两种分子.
回答下列问题:
(1)B在元素周期表中的位置为
(2)化合物乙的电子式为
 .
.
(3)B、E的单质及两元素之间形成的化合物中可作水消毒剂的有
(4)A2D的燃烧热△H=-a kJ/mol,写出A2D燃烧反应的热化学方程式:
(5)写出FeE2与物质丁按物质的量之比2:1的反应的离子方程式:
(6)熔融状态下,C的单质和FeE2能组成可充电电池(装置示意图如下),反应原理为:2Z+FeE2
Fe+2ZE
放电时,电池的正极反应式为
以二甲醚(CH3OCH3)、空气、氢氧化钾溶液为原料,石墨为电极可构成一种性能优良的高效燃料电池.给上述电池充电,则与a电极相连的二甲醚电池电极上的反应式为
查看习题详情和答案>>

回答下列问题:
(1)B在元素周期表中的位置为
第二周期ⅥA族
第二周期ⅥA族
.(2)化合物乙的电子式为


(3)B、E的单质及两元素之间形成的化合物中可作水消毒剂的有
O3、Cl2、ClO2等
O3、Cl2、ClO2等
(写出其中两种物质的化学式)).(4)A2D的燃烧热△H=-a kJ/mol,写出A2D燃烧反应的热化学方程式:
2H2S+3O2=2SO2(g)+2H2O(l)△H=-2akJ/mol
2H2S+3O2=2SO2(g)+2H2O(l)△H=-2akJ/mol
.(5)写出FeE2与物质丁按物质的量之比2:1的反应的离子方程式:
6Fe2++3Na2O2+6H2O=4Fe(OH)3↓+2Fe3++6Na+
6Fe2++3Na2O2+6H2O=4Fe(OH)3↓+2Fe3++6Na+
.(6)熔融状态下,C的单质和FeE2能组成可充电电池(装置示意图如下),反应原理为:2Z+FeE2
| 放电 | 充电 |
放电时,电池的正极反应式为
Fe2++2e-=Fe
Fe2++2e-=Fe
.以二甲醚(CH3OCH3)、空气、氢氧化钾溶液为原料,石墨为电极可构成一种性能优良的高效燃料电池.给上述电池充电,则与a电极相连的二甲醚电池电极上的反应式为
CH3OCH3+16OH--12e-=2CO32-+11H2O
CH3OCH3+16OH--12e-=2CO32-+11H2O
.A、B、C、D、E、F都是短周期元素,原子序数依次增大,B、C、D同周期,A、E同主族.A、C能形成两种液态化合物甲和乙,原子个数比分别为2:1和1:1.B元素基态原子有两个未成对电子,D是周期表中电负性最大的元素,F是地壳中含量最多的金属元素.根据以上信息回答下列问题:
(1)D元素的名称为
(2)C、D、F的简单离子中,半径最小的是
(3)BA4的空间构型为
(4)由这六种元素形成的单质和化合物中,可以相互反应生成H2的化学方程式为
(5)下列关于甲和乙的说法中,错误的是
①乙分子中含有非极性键,一定是非极性分子
②甲的沸点较高与分子间形成氢键有关
③甲中中心原子采取sp2杂化
④乙在一定条件下可以分解生成甲
⑤甲分子中极性键的极性向量和为零.
查看习题详情和答案>>
(1)D元素的名称为
氟
氟
,E的电子排布式为ls22s22p63s1
ls22s22p63s1
;(2)C、D、F的简单离子中,半径最小的是
Al3+
Al3+
(填离子符号);(3)BA4的空间构型为
正四面体
正四面体
,B、C两元素形成的非极性分子的结构式为O=C=O
O=C=O
;(4)由这六种元素形成的单质和化合物中,可以相互反应生成H2的化学方程式为
2Na+2H2O=2NaOH+H2↑
2Na+2H2O=2NaOH+H2↑
,可以相互反应生成O2的化学方程式为2Na2O2+CO2═2Na2CO3+O2
2Na2O2+CO2═2Na2CO3+O2
;(5)下列关于甲和乙的说法中,错误的是
①③⑤
①③⑤
(填序号)①乙分子中含有非极性键,一定是非极性分子
②甲的沸点较高与分子间形成氢键有关
③甲中中心原子采取sp2杂化
④乙在一定条件下可以分解生成甲
⑤甲分子中极性键的极性向量和为零.
A、B、C、D、E、F六种元素,其中A、B、C、D、E为短周期主族元素.它们之间的关系如下:
Ⅰ.原子半径:A<C<B<E<D
Ⅱ.原子的最外层电子数:A=D C=E A+B=C
Ⅲ.原子的核外电子层数:B=C=2A
Ⅳ.B元素的主要化合价:最高正价+最低负价=2
请回答:
(1)甲为由A、B两种元素组成的常见气体,写出其电子式
 ;乙为由B元素组成的单质,写出该单质的一种用途
;乙为由B元素组成的单质,写出该单质的一种用途
(2)写出某黑色含F的磁性氧化物在E的最高价氧化物对应水化物的稀溶液中反应的离子方程式:
(3)向A、B、C三种元素组成的某盐溶液中滴加AgNO3溶液生成白色沉淀,该反应的化学方程式为
(4)写出C和D形成的化合物与EC2发生氧化还原反应的化学方程式,并标出电子转移的方向和数目:
 .
.
(5)上述元素中的五种元素可形成一种常见复盐,经检测该复盐中三种离子的个数比为2:1:2.则该复盐的化学式为
查看习题详情和答案>>
Ⅰ.原子半径:A<C<B<E<D
Ⅱ.原子的最外层电子数:A=D C=E A+B=C
Ⅲ.原子的核外电子层数:B=C=2A
Ⅳ.B元素的主要化合价:最高正价+最低负价=2
请回答:
(1)甲为由A、B两种元素组成的常见气体,写出其电子式


作保护气
作保护气
.(2)写出某黑色含F的磁性氧化物在E的最高价氧化物对应水化物的稀溶液中反应的离子方程式:
Fe3O4+8H+═2Fe3++Fe2++4H2O
Fe3O4+8H+═2Fe3++Fe2++4H2O
(3)向A、B、C三种元素组成的某盐溶液中滴加AgNO3溶液生成白色沉淀,该反应的化学方程式为
NH4NO2+AgNO3═AgNO2↓+NH4NO3
NH4NO2+AgNO3═AgNO2↓+NH4NO3
,已知该盐溶液常温下呈酸性,则0.1mol/L该盐溶液中离子浓度的大小顺序为C(NO2->C(NH4+)>C(H+)>C(OH-)
C(NO2->C(NH4+)>C(H+)>C(OH-)
(4)写出C和D形成的化合物与EC2发生氧化还原反应的化学方程式,并标出电子转移的方向和数目:


(5)上述元素中的五种元素可形成一种常见复盐,经检测该复盐中三种离子的个数比为2:1:2.则该复盐的化学式为
(NH4)2Fe(SO4)2
(NH4)2Fe(SO4)2
.为探究该复盐中的某种离子,取少量该复盐于试管中并加水溶解,滴加铁氰化钾溶液(K3[Fe(CN)6]),则现象和结论为出现蓝色沉淀,证明有Fe2+
出现蓝色沉淀,证明有Fe2+
.A、B、C、D、E是五种常见的短周期主族元素,它们的原子序数依次增大,其中A与C、B与D分别同族,已知B、D两种元素原子核中质子数之和是A、C两种元素原子核中质子数的2倍,五种元素中只有一种为金属元素.请回答下列问题
(1)物质甲、乙是由上述五种元素中的两种元素形成的常温下为液体的化合物,则甲、乙的化学式
(2)已知:2DB2+B2 2DB3,若3.2gDB2完全转化为DB3气体时放热akJ;1mol DB3气体完全转化为其水化物放热bkJ,则标况下33.6L DB2完全完成上述两步反应放热
2DB3,若3.2gDB2完全转化为DB3气体时放热akJ;1mol DB3气体完全转化为其水化物放热bkJ,则标况下33.6L DB2完全完成上述两步反应放热
(3)丙、丁两化合物均由A、B、C、D四种元素组成,写出丙丁两化合物反应的化学反应方程式:
(4)将一定量的DB2通入到紫色石蕊试液中的现象是:
(5)用A、B两元素的单质可制成新型化学电源,若以C的最高价氧化物的水化物为电解质,则通A的一极的电极反应方程式:
查看习题详情和答案>>
(1)物质甲、乙是由上述五种元素中的两种元素形成的常温下为液体的化合物,则甲、乙的化学式
H2O或H2O2
H2O或H2O2
、H2O2或H2O
H2O2或H2O
,写出其中一种物质使酸性KMnO4溶液褪色的离子反应方程式5H2O2+2MnO4-+6H+═2Mn2++8H2O+5O2↑
5H2O2+2MnO4-+6H+═2Mn2++8H2O+5O2↑
.(2)已知:2DB2+B2
 2DB3,若3.2gDB2完全转化为DB3气体时放热akJ;1mol DB3气体完全转化为其水化物放热bkJ,则标况下33.6L DB2完全完成上述两步反应放热
2DB3,若3.2gDB2完全转化为DB3气体时放热akJ;1mol DB3气体完全转化为其水化物放热bkJ,则标况下33.6L DB2完全完成上述两步反应放热(30a+1.5b)
(30a+1.5b)
kJ(用a、b表示),我国工业生成DB2所用的原料是FeS2
FeS2
(填化学式)(3)丙、丁两化合物均由A、B、C、D四种元素组成,写出丙丁两化合物反应的化学反应方程式:
NaHSO4+NaHSO3═Na2SO4+SO2↑+H2O
NaHSO4+NaHSO3═Na2SO4+SO2↑+H2O
.(4)将一定量的DB2通入到紫色石蕊试液中的现象是:
溶液变为红色
溶液变为红色
.再通入等物质的量E2所观察的现象是溶液仍为红色
溶液仍为红色
.(5)用A、B两元素的单质可制成新型化学电源,若以C的最高价氧化物的水化物为电解质,则通A的一极的电极反应方程式:
H2+2OH--2e-→2H2O
H2+2OH--2e-→2H2O
.若以此电源进行铁片上镀铜,若两极质量差为6.4g时,理论上消耗标况下1.12
1.12
L的A单质.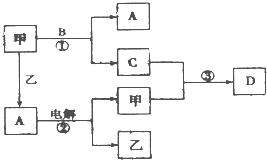 A、B、C、D是由短周期元素组成的四种常见的化合物,D为红棕色气体,甲、乙是两种单质,这些单质和化合物之间存在如图所示的转化关系:
A、B、C、D是由短周期元素组成的四种常见的化合物,D为红棕色气体,甲、乙是两种单质,这些单质和化合物之间存在如图所示的转化关系:(1)上述转化过程中包含的反应类型有
BC
BC
(填序号)A.置换反应B.化合反应C.分解反应D.复分解反应
(2)在反应②中,阳极的电极反应方程式为
4OH--4e-=2H2O+O2↑
4OH--4e-=2H2O+O2↑
;(3)乙在甲中燃烧,当有1mol电子转移,生成液态A时,放出142.9kJ的热量,则该反应的热化学方程式为
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol
2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ/mol
;(4)反应③在一定条件下为可逆反应,若将3mol甲和4molC混合充入2L的密闭容器中,2min后达到平衡.平衡后混合气体的总物质的量为6mol,则甲的反应速率为
0.25mol/(L.min)
0.25mol/(L.min)
,该平衡混合气体溶于水,恰好完全被水吸收,该反应的总化学方程式为NO+NO2+O2+H2O═HNO3
NO+NO2+O2+H2O═HNO3
.(5)胶态磁流体在医学上有重要的用途,而纳米级Fe3O4是磁流体中的重要粒子,其制备过程简单表示如下:
①将气体B通入等物质的量混合的FeSO4、Fe2(SO4)3溶液中,生成两种碱,写出该过程的总离子方程式:
Fe2++2Fe3++8NH3.H2O═Fe(OH)2↓+2Fe(OH)3↓+NH4+
Fe2++2Fe3++8NH3.H2O═Fe(OH)2↓+2Fe(OH)3↓+NH4+
;②上述反应生成的两种碱继续作用,得到Fe3O4,该反应的化学方程式为
Fe(OH)2+2Fe(OH)3═Fe3O4+4H2O
Fe(OH)2+2Fe(OH)3═Fe3O4+4H2O
.