摘要:O2.SO2.SO3三者的质量之比为2:4:5时.它们的物质的量之比为( ) A.2:5:5 B.1:2:3 C 1:1:1 D 2:2:3
网址:http://m.1010jiajiao.com/timu3_id_173495[举报]
工业废气、汽车尾气排放出的SO2、NOx等,是形成雾霾的重要因素.霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾.
(1)SO2在烟尘的催化下形成硫酸的反应方程式是 .
(2)已知2SO2(g)+O2(g)?2SO3(g)△H=-196kJ/mol,提高反应中SO2的转化率,是减少SO2排放的有效措施.
①T温度时,在2L容积固定不变的密闭容器中加入2.0mol SO2和1.0mol O2,5min后反应达到平衡,二氧化硫的转化率为50%,则υ(O2)= .
②在①的条件下,判断该反应达到平衡状态的标志是 (填字母).
a.SO2、O2、SO3三者的浓度之比为2:1:2 b.容器内气体的压强不变
c.容器内混合气体的密度保持不变 d.SO3的物质的量不再变化
e.SO2的生成速率和SO3的生成速率相等
(3)烟气中的SO2可以用NaOH溶液吸收,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如图所示.(电极材料为石墨)
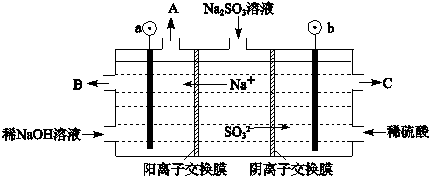
①图中a极要连接电源的(填“正”或“负”) 极,C口流出的物质是 .
②SO32-放电的电极反应式为 .
③电解过程中若消耗12.6g Na2SO3,则阴极区变化的质量为 g(假设该过程中所有液体进出口密闭).
查看习题详情和答案>>
(1)SO2在烟尘的催化下形成硫酸的反应方程式是
(2)已知2SO2(g)+O2(g)?2SO3(g)△H=-196kJ/mol,提高反应中SO2的转化率,是减少SO2排放的有效措施.
①T温度时,在2L容积固定不变的密闭容器中加入2.0mol SO2和1.0mol O2,5min后反应达到平衡,二氧化硫的转化率为50%,则υ(O2)=
②在①的条件下,判断该反应达到平衡状态的标志是
a.SO2、O2、SO3三者的浓度之比为2:1:2 b.容器内气体的压强不变
c.容器内混合气体的密度保持不变 d.SO3的物质的量不再变化
e.SO2的生成速率和SO3的生成速率相等
(3)烟气中的SO2可以用NaOH溶液吸收,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如图所示.(电极材料为石墨)

①图中a极要连接电源的(填“正”或“负”)
②SO32-放电的电极反应式为
③电解过程中若消耗12.6g Na2SO3,则阴极区变化的质量为