摘要:10.把0.5mol钠和0.5mol镁分别投入m1 g水和m2 g盐酸中.分别得到溶液a和溶液B.若m1 =m2.则a和 b的质量关系为 ( ) A.ma >mb B.ma < mb C.ma = mb D.无法确定
网址:http://m.1010jiajiao.com/timu3_id_172729[举报]
把
0.5mol Na和0.5 mol Mg分别投入到过量的m1g水和m2g盐酸中,分别得到溶液a和b.若m1=m2,则a与b的质量关系是[
]A
.ma>mb B.ma<mbC
.ma=mb D.无法确定 查看习题详情和答案>>以天然气为原料合成尿素的主要步骤如图所示(图中某些转化步骤及生成物未列出):

请填写下列空白:
(1)已知0.5mol甲烷和0.5mol水蒸气在t℃,p kPa时,完全反应生成一氧化碳和氢气(合成气),吸收了a kJ热量.该反应的热化学方程式是:
(2)在合成氨的实际生产过程中,常采取的措施之一是:将生成的氨从混合气体中及时分离出来,并将分离出氨后的氮气和氢气循环利用,同时补充氮气和氢气请应用化学反应速率和化学平衡的观点说明采取该措施的理由:
(3)当甲烷合成氨气的转化率为75%时,以5.60×107L甲烷为原料能够合成
(4)已知尿素的结构简式为 ,请写出两种含有碳氧双键的尿素的同分异构体的结构简式:
,请写出两种含有碳氧双键的尿素的同分异构体的结构简式:
①
 ;②
;②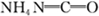
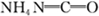 .
.
查看习题详情和答案>>

请填写下列空白:
(1)已知0.5mol甲烷和0.5mol水蒸气在t℃,p kPa时,完全反应生成一氧化碳和氢气(合成气),吸收了a kJ热量.该反应的热化学方程式是:
CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+2aKJ/mol
CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+2aKJ/mol
.(2)在合成氨的实际生产过程中,常采取的措施之一是:将生成的氨从混合气体中及时分离出来,并将分离出氨后的氮气和氢气循环利用,同时补充氮气和氢气请应用化学反应速率和化学平衡的观点说明采取该措施的理由:
增大氢气和氮气的浓度有利于增大反应速率,增大氢气和氮气浓度,减少氨气浓度有利于平衡正向进行
增大氢气和氮气的浓度有利于增大反应速率,增大氢气和氮气浓度,减少氨气浓度有利于平衡正向进行
(3)当甲烷合成氨气的转化率为75%时,以5.60×107L甲烷为原料能够合成
1.12×108
1.12×108
L氨气(假设体积均在标准状况下测定).(4)已知尿素的结构简式为
 ,请写出两种含有碳氧双键的尿素的同分异构体的结构简式:
,请写出两种含有碳氧双键的尿素的同分异构体的结构简式:①


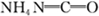
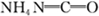
 工业上生产硫酸时,将SO2氧化为SO3是关键一步.
工业上生产硫酸时,将SO2氧化为SO3是关键一步.(1)某温度下,2 SO2(g)+O2(g)?2SO3(g);△H=-196kJ?mol-1.开始时在10L的密闭容器中加入4.0mol SO2(g)和5.0mol O2(g),当反应达到平衡时共放出热量196kJ,该温度下平衡常数K=
2.5L/mol
2.5L/mol
.(2)一定条件下,向一带活塞的密闭容器中充入2mol SO2和1mol O2,发生下列反应:2SO2(g)+O2(g)?2SO3(g)达到平衡后改变下述条件,SO2、O2、SO3气体平衡浓度都比原来增大的是
ACF
ACF
.A.保持温度和容器体积不变,充入2mol SO3
B.保持温度和容器体积不变,充入2mol N2
C.保持温度和容器体积不变,充入0.5mol SO2和0.25mol O2
D.保持温度和容器内压强不变,充入1mol SO3
E.升高温度
F.移动活塞压缩气体
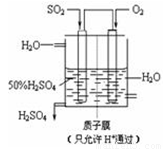
(3)某人设想以右上图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式:
SO2+2H2O→SO42-+4 H++2e-
SO2+2H2O→SO42-+4 H++2e-
.(4)在0.1mol?L-1的(NH4)2SO4溶液中,离子浓度由大到小的顺序是
c(NH4+)>c (SO42-)>c (H+)>c (OH-)
c(NH4+)>c (SO42-)>c (H+)>c (OH-)
.(8分)工业上生产硫酸时,将SO2氧化为SO3是关键一步。
(1)某温度下,SO2(g)+1/2O2(g) SO3(g);△H=—98 kJ·mol—1。开始时在 10L的密闭容
SO3(g);△H=—98 kJ·mol—1。开始时在 10L的密闭容
器中加入4.0mol SO2(g)和5.0molO2(g),当反应达到平衡时共放出热量196 kJ,该温度下平衡常数K= 。
(2)一定条件下,向一带活塞的密闭容器中充入2molSO2和1molO2,发生下列反应:2SO2(g)+O2(g) 2SO3(g)达到平衡后改变下述条件,SO2、O2、SO3气体平衡浓度都比原来增大的是
。
2SO3(g)达到平衡后改变下述条件,SO2、O2、SO3气体平衡浓度都比原来增大的是
。
A.保持温度和容器体积不变,充入2mol SO3
B.保持温度和容器体积不变,充入2mol N2
C.保持温度和容器体积不变,充入0.5mol SO2和0.25mol O2
D.保持温度和容器内压强不变,充入1mol SO3
E.升高温度 F.移动活塞压缩气体
(3)某人设想以下图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式: 。
(4)在0.1mol·L-1的(NH4)2SO4溶液中,离子浓度由大到小的顺序是 。
查看习题详情和答案>>
将1mol SO2和1mol O2通入一个固定容积的密闭容器中,在一定温度下反应达到平衡,平衡体系中有SO3 0.3mol,此时若移走0.5mol O2和0.5 mol SO2,则反应达到新平衡时SO3的物质的量为( )
| A.0.3mol | B. 0.15mol |
| C.小于0.15mol | D.大于0.15mol,小于0.3mol |