网址:http://m.1010jiajiao.com/timu3_id_172414[举报]

(1)上图装置存在不足,请在图中C处画出所需装置并标注试剂名称


(2)实验前要检查A、B装置的气密性,其操作为在接口E处接一导气管F,将F的末端浸入液面以下,
(3)为探究该反应产生的气体性质,将网个棉球上分别滴加少量试剂,按图示安好装置,加热试管A,观察四个棉球颜色变化情况,并记录,请填写下表空白:
| 棉球 | 棉球上滴加的试剂 | 实验现象 | 解释或结论 |
| i | 品红溶液 品红溶液 |
棉球变为白色,微热后又恢复红色 | |
| ii | FeCl3溶液 FeCl3溶液 |
棉球变为浅绿色 | 离子方程式: SO2+2Fe3++2H2O=2Fe3++SO42ˉ+4H+ SO2+2Fe3++2H2O=2Fe3++SO42ˉ+4H+ 结论: SO2有还原性 SO2有还原性 |
| iii | Na2S溶液 | 棉球变为浅黄色 | 解释:浅黄色物质是 S S 结论: SO2有氧化性 SO2有氧化性 |
| iv | 石蕊试液 石蕊试液 |
棉球变为红色 | 化学方程式: SO2+H2O?H2SO3 SO2+H2O?H2SO3 结论:该气体属于酸性氧化物 |
(5)为探究试管A反应后的溶液中产物种类,小组同学提出3种假设,①只含有Fe3+②只含有Fe2+③既含有Fe3+又含有Fe2+,完成此探究实验所需试剂至少有
分别回答下列问题。(10分)
(1)从H+、Na+、Cu2+、Cl-、![]() 中选出两种离子组成电解质,按下列要求进行电解(使用惰性电极),将电解质的化学式填空:(只写出一种即可)
中选出两种离子组成电解质,按下列要求进行电解(使用惰性电极),将电解质的化学式填空:(只写出一种即可)
①电解过程中溶液颜色变浅且水量不变_______________________;
②电解过程中电解质含量不变,水量减少_______________________;
③电解过程中,两极析出气体的体积比为1∶1__________。
(2)①用惰性电极电解硫酸铜溶液,若阴极上有1.6克铜析出,则阳极上产生的气体
在标准状况下的体积约为 ;
②用铂电极电解0.02 mol/L硫酸铜溶液,直至铜完全析出,所得溶液中氢离子浓度为
(忽略溶液体积的变化) ;
③已知下列两个热化学方程式2H2(g)+O2(g)=2H2O(1) △H= -571.6KJ
 C3H8(g) +5O2(g)=3CO2(g)+4H2O(1) △H=-2220.0kJ
C3H8(g) +5O2(g)=3CO2(g)+4H2O(1) △H=-2220.0kJ
实验测得,5mol氢气和丙烷的混合气体完全燃烧时放热
3847kJ,则混合气体中氢气与丙烷的体积比是 。
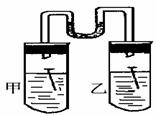
(3)如右图所示,甲、乙两试管中各放一枚铁钉,甲试管中
为NaCl溶液,乙试管为稀醋酸溶液,数天后观察到的现象
是 ,甲中正极反应为
,负极反应式为,乙中正极反应为 ,负极反应式为 。
查看习题详情和答案>> 分别回答下列问题.
分别回答下列问题.(1)从H+、Na+、Cu2+、Cl-、S
| O | 2- 4 |
①电解过程中溶液颜色变浅且水量不变
②电解过程中电解质含量不变,水量减少
③电解过程中,两极析出气体的体积比为1:1
(2)①用惰性电极电解硫酸铜溶液,若阴极上有1.6克铜析出,则阳极上产生的气体在标准状况下的体积约为
②用铂电极电解0.02mol/L硫酸铜溶液,直至铜完全析出,所得溶液中氢离子浓度为(忽略溶液体积的变化)
③已知下列两个热化学方程式2H2(g)+O2(g)=2H2O(1)△H=-571.6KJ;C3H8(g)+5O2(g)=3CO2(g)+4H2O(1)△H=-2220.0kJ实验测得,5mol氢气和丙烷的混合气体完全燃烧时放热3847kJ,则混合气体中氢气与丙烷的体积比是
(3)如图所示,甲、乙两试管中各放一枚铁钉,甲试管中为NaCl溶液,乙试管为稀醋酸溶液,数天后观察到的现象
是
(1)首先制备CuO,实验步骤如下,请完成缺少的步骤:
①称取10g胆矾,放入小烧杯中,再加水溶解;②向小烧杯中滴加NaOH溶液,至产生大量沉淀;③用酒精灯在石棉网上加热小烧杯,至沉淀物完全黑色;④将以上混合物过滤,洗涤,
(2)用图1所示,按表中设计实验方法,证明CuO能催化7%H2O2溶液的分解,并与MnO2的催化效果进行比较.
| 实验序号 | 双氧水体积 | 催化剂 | 待测数据 |
| a | 15mL | 无 | |
| b | 15mL | 0.5g CuO | |
| c | 15mL | 0.5g MnO2 |
②为探究CuO在实验b中是否起催化作用,除与
a比较外,还应补充以下实验(不必写具体操作):
A.证明CuO化学性质在反应前后是否改变;
B.
Ⅱ.摩尔盐[(NH4)2SO4?FeSO4?6H2O]
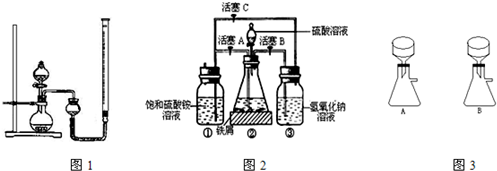
在空气中比一般亚铁盐稳定,是化学分析中常用的还原剂.某研究性学习小组用图2所示的实验装置来制取摩尔盐,实验步骤如下,回答下列问题:
(1)用30%的NaOH溶液和废铁屑(含少量油污、铁锈、FeS等)混合、煮沸、冷却、分离,将分离出的NaOH溶液装入③中.
(2)利用容器②的反应,向容器①中通入氢气,应关闭活塞
(3)待锥形瓶中的铁屑快反应完时,关闭活塞B、C,打开活塞A,继续产生的氢气会将锥形瓶中的硫酸亚铁(含极少部分未反应的稀硫酸)压到饱和硫酸铵溶液的底部.在常温下放置一段时间,试剂瓶底部将结晶出硫酸亚铁铵,抽滤,制得硫酸亚铁铵晶体.图3是抽滤装置的一部分,其中正确的是
(4)为了确定产品中亚铁离子的含量,研究小组用滴定法来测定.若取产品24.50g配成100mL溶液,取出10.00mL用0.1000mol?L-1KMnO4酸性溶液滴定,消耗KMnO4溶液10.00mL.
已知高锰酸钾与Fe2+的离子方程式为:MnO
- 4 |
试求产品中摩尔盐的质量分数