摘要:下表为元素周期表的一部分.请按要求回答问题: 族 周期 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0 2 ① ② ③ ④ ⑤ 3 ⑥ ⑦ ⑧ ⑨ (1)表中元素 ▲ 的非金属性最强.元素 ▲ 的金属性最强. (2)表中元素③的原子结构示意图 ▲ ,元素⑨形成的氢化物的电子式 ▲ . (3)表中元素④.⑨形成的氢化物的稳定性顺序为 ▲ > ▲ . (4)表中元素⑧和⑨的最高价氧化物对应水化物的酸性强弱为 ▲ > ▲ . (5)表中元素③.④.⑥.⑦的原子半径大小为 ▲ > ▲ > ▲ > ▲ .
网址:http://m.1010jiajiao.com/timu3_id_172183[举报]
下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
(1)④、⑤、⑥的原子半径由大到小的顺序是
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式: 或
或 
 或
或  .
.
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4.
查看习题详情和答案>>
| 族 周期 |
ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅥⅠ | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
Na>Al>O
Na>Al>O
.(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是
HNO3>H2CO3>H2SiO3
HNO3>H2CO3>H2SiO3
.(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:
 或
或 
 或
或 
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)
ab
ab
.a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4.
下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题: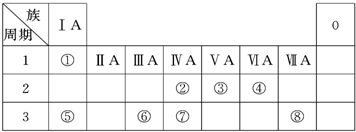
(1)地壳中含量居于第二位的元素在周期表中的位置是
(2)②、⑦的最高价含氧酸的酸性是由强到弱的,用原子结构解释原因:
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含共价键的离子化合物,写出其中一种化合物的电子式
 .
.
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,下列物质不能做该反应催化剂的是(填序号)
a.MnO2 b.CuSO4 c.Na2SO3 d.FeCl3
(5)W与④是相邻的同主族元素.在下表中列出H2WO3的各种不同化学性质,举例并写出相应的化学方程式.
(6)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应(如图):
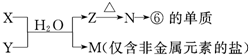
X溶液与Y溶液反应的离子方程式
N→⑥的单质的化学方程式为
M溶液中离子浓度由大到小的排列顺序是
M中阳离子的鉴定方法
查看习题详情和答案>>

(1)地壳中含量居于第二位的元素在周期表中的位置是
第三周期第IVA族
第三周期第IVA族
.(2)②、⑦的最高价含氧酸的酸性是由强到弱的,用原子结构解释原因:
同一主族元素从上到下原子核外电子层数依次增多
同一主族元素从上到下原子核外电子层数依次增多
,原子半径逐渐增大,得电子能力逐渐减弱,非金属性逐渐减弱.(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含共价键的离子化合物,写出其中一种化合物的电子式


(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,下列物质不能做该反应催化剂的是(填序号)
c
c
.a.MnO2 b.CuSO4 c.Na2SO3 d.FeCl3
(5)W与④是相邻的同主族元素.在下表中列出H2WO3的各种不同化学性质,举例并写出相应的化学方程式.
| 编号 | 性质 | 化学方程式 |
| 示例 | 氧化性 | H2WO3+3H3PO3═3H3PO4+H2W↑ |
| 1 | 还原性 还原性 |
H2SO3+Br2+2H2O=H2SO3+2HBr H2SO3+Br2+2H2O=H2SO3+2HBr |
| 2 | 酸性 酸性 |
H2SO3+2NaOH=Na2SO3+2H2O H2SO3+2NaOH=Na2SO3+2H2O |

X溶液与Y溶液反应的离子方程式
Al3++3NH3+3H2O=Al(OH)3↓+3NH4+
Al3++3NH3+3H2O=Al(OH)3↓+3NH4+
,N→⑥的单质的化学方程式为
2Al2O3(熔融)
4Al+3O2↑
| ||
| 冰晶石 |
2Al2O3(熔融)
4Al+3O2↑
,
| ||
| 冰晶石 |
M溶液中离子浓度由大到小的排列顺序是
c(Cl-)>c(NH4+)>c(H+)>c(OH-)或c(NO3-)>c(NH4+)>c(H+)>c(OH-)
c(Cl-)>c(NH4+)>c(H+)>c(OH-)或c(NO3-)>c(NH4+)>c(H+)>c(OH-)
,M中阳离子的鉴定方法
取少量M样品放入试管,加入氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子
取少量M样品放入试管,加入氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子
.下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:
(1)④、⑤、⑥的原子半径由大到小的顺序是
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式: 或
或 
 或
或  .
.
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
(5)写出⑥的最高价氧化物对应水化物的电离方程式
查看习题详情和答案>>
| 族 周期 |
ⅠA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
Na>Al>O
Na>Al>O
.(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是
HNO3>H2CO3>H2SiO3
HNO3>H2CO3>H2SiO3
.(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:
 或
或 
 或
或 
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为
ab
ab
(填序号).a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
(5)写出⑥的最高价氧化物对应水化物的电离方程式
AlO2-+H++H2O?Al(OH)3?Al3++3OH-
AlO2-+H++H2O?Al(OH)3?Al3++3OH-
.下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
(1)④、⑤、⑥的原子半径由大到小的顺序为
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含共价键的化合物,写出其中一种化合物的电子式: 或
或
 或
或 .
.
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号)
a.MnO2 b.AlCl3 c.Na2SO3 d.KMnO4
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:

X溶液与Y溶液反应的离子方程式为
(6)已知破坏1mol N≡N键、H-H键、N-H键分别需要吸收的能量为946kJ、436kJ、391kJ.则1molN2完全反应转化为NH3共
查看习题详情和答案>>
| 族 周期 |
IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
Na>Al>O
Na>Al>O
(用元素符号表示).(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是
HNO3>H2CO3>H2SiO3
HNO3>H2CO3>H2SiO3
.(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含共价键的化合物,写出其中一种化合物的电子式:
 或
或
 或
或
(4)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号)
a
a
.a.MnO2 b.AlCl3 c.Na2SO3 d.KMnO4
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:

X溶液与Y溶液反应的离子方程式为
Al3++3NH3?H2O=Al(OH)3↓+3NH4+
Al3++3NH3?H2O=Al(OH)3↓+3NH4+
,N→⑥的单质的化学方程式为2Al2O3(熔融)
4Al+3O2↑
| ||
| 冰晶石 |
2Al2O3(熔融)
4Al+3O2↑
.
| ||
| 冰晶石 |
(6)已知破坏1mol N≡N键、H-H键、N-H键分别需要吸收的能量为946kJ、436kJ、391kJ.则1molN2完全反应转化为NH3共
放出
放出
(填“吸收”或“放出”)能量92
92
kJ.下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
(1)④、⑥、⑦的原子半径由小到大的顺序为
(2)②、③、⑧的最高价含氧酸的酸性由弱到强的顺序是
(3)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,请写出该化合物的电子式
 结构式
结构式
(4)研究表明:②的最高价氧化物在一定条件下可被还原为晶莹透明的晶体N,其结构中原子的排列为正四面体,请写出N及其2种同素异形体的名称
查看习题详情和答案>>
| 族 周期 |
IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
O<Si<Al
O<Si<Al
.(2)②、③、⑧的最高价含氧酸的酸性由弱到强的顺序是
H2CO3<HNO3<HClO4
H2CO3<HNO3<HClO4
.(3)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,请写出该化合物的电子式


H-O-O-H
H-O-O-H
.(4)研究表明:②的最高价氧化物在一定条件下可被还原为晶莹透明的晶体N,其结构中原子的排列为正四面体,请写出N及其2种同素异形体的名称
金刚石
金刚石
、石墨、足球烯或石墨烯
石墨、足球烯或石墨烯
.