摘要:(1)用电子式表示上列元素中最活泼的金属元素与最活泼的非金属元素所形成化合物的过程 . (2)镁.铝最高价氧化物对应的水化物中.碱性比较强的是 . (3)在ⅦA元素(Br.I分别位于第四.五周期)中.能够证明Cl2 的氧化性比I2 的氧化性强的实验是 .
网址:http://m.1010jiajiao.com/timu3_id_172004[举报]
下表列出了①~⑩十种元素在周期表中的位置:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | | | | ① | ② | | | |
| 3 | ③ | ④ | ⑤ | ⑥ | | ⑦ | ⑧ | ⑩ |
| 4 | | | | | | | ⑨ | |
构成有机物的主要元素是 ,构成岩石与许多矿物的基本元素是 ,
化学性质最不活泼的元素 ,气态氢化物的水溶液呈碱性的元素 。
⑵上述①~⑨元素的最高价氧化物对应的水化物中:
碱性最强的物质的电子式为 ,酸性最强的物质的化学式为 。
⑶若以元素④和⑤的单质为电极,与元素③的最高价氧化物对应的水化物的水溶液组成原电池,则④的单质在此原电池中作______极(填“正”或“负”)
⑷元素⑦的某氧化物为有刺激性气味的无色气体,其氢化物为有臭鸡蛋气味的无色气体。若这两种气体混合,会生成一种淡黄色粉末。此反应化学方程式为 。若此反应中氧化产物的质量为3.2g,则反应中转移的电子数为 (填数值)。
⑸元素⑧和元素⑨两者核电荷数之差是 ,这两种元素中非金属性较弱的元素是 (填元素名称),能说明这两种元素的非金属性强弱的实验事实是(用离子方程式表示)
。 查看习题详情和答案>>
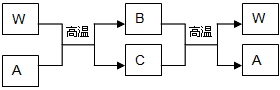
X、Y、Z三种短周期元素,原子序数依次增大,其最外层电子数之和为15,它们分别是所在周期最活泼的金属或非金属元素.其中Y元素的单质在空气中可形成两种氧化物,其阴、阳离子个数比均为1:2.另有一常见金属W与常温下为液态的化合物A在一定条件下可发生如下变化:

请完成下列问题:
(1)、X、Y、Z三种元素的离子半径由大到小的顺序为
(2)、X、Z及第VIA族第一种元素的氢化物的沸点由高到低的顺序为
(3)、Y元素最高价氧化物对应水化物的电子式为
 .
.
(4)、W与Z的单质在一定条件下剧烈反应生成一种棕黄色的固体,将该固体溶于水得一黄色溶液,写出检验该溶液中金属离子的离子方程式(写一个)
(5)、B为黑色固体,在上述变化中,生成1molB转移电子
(6)、以(4)中的黄色溶液为电解质,W及另一种材料为电极构成原电池,5分钟后,W减轻10g,则另一种材料为
查看习题详情和答案>>

请完成下列问题:
(1)、X、Y、Z三种元素的离子半径由大到小的顺序为
Cl-F-Na+
Cl-F-Na+
(用离子符号表示).(2)、X、Z及第VIA族第一种元素的氢化物的沸点由高到低的顺序为
HF、HCl
HF、HCl
(用氢化物的分子式表示).(3)、Y元素最高价氧化物对应水化物的电子式为


(4)、W与Z的单质在一定条件下剧烈反应生成一种棕黄色的固体,将该固体溶于水得一黄色溶液,写出检验该溶液中金属离子的离子方程式(写一个)
Fe3++3SCN??Fe(SCN)3或Fe3++3OH?=Fe(OH)3↓
Fe3++3SCN??Fe(SCN)3或Fe3++3OH?=Fe(OH)3↓
.(5)、B为黑色固体,在上述变化中,生成1molB转移电子
8
8
mol.(6)、以(4)中的黄色溶液为电解质,W及另一种材料为电极构成原电池,5分钟后,W减轻10g,则另一种材料为
石墨或铜
石墨或铜
,电池总反应为Fe+2Fe3+=3Fe2+或Fe+2FeCl3=3FeCl2
Fe+2Fe3+=3Fe2+或Fe+2FeCl3=3FeCl2
.据元素周期表及周期律的知识回答下列问题:
(1)请在下图所示元素周期表中用实线画出前36号元素所在的范围的边界.
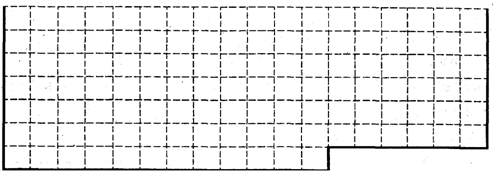
(2)下列比较元素性质的递变规律正确的是 .
a.离子半径:Na+>Mg2+>S2->Cl- b.酸性:HClO4>H2SO4>H3PO4>H4SiO4
c.氢化物稳定性:H2O>H2S>PH3>SiH4 d.NH3结合H+的能力比H2O弱
(3)元素甲是第三周期ⅦA族元素,甲元素与另两种非金属元素可组成离子化合物A.写出A的电子式 .工业上可用MnSO4溶液吸收氯气,获得Mn2O3,请写出该化学反应的化学方程式 .
(4)氮和氧都是较活泼的非金属元素,用一个化学方程式说明两种单质的氧化性强弱 .
(5)在所有元素的气态氢化物中,元素乙的氢化物最稳定,写出元素乙的单质与水反应的化学方程式 .
(6)0.1mol的单质Cl2与100mL1.5mol/L的FeBr2溶液反应,则被氧化的Fe2+和Br-的物质的量之比是 .
查看习题详情和答案>>
(1)请在下图所示元素周期表中用实线画出前36号元素所在的范围的边界.

(2)下列比较元素性质的递变规律正确的是
a.离子半径:Na+>Mg2+>S2->Cl- b.酸性:HClO4>H2SO4>H3PO4>H4SiO4
c.氢化物稳定性:H2O>H2S>PH3>SiH4 d.NH3结合H+的能力比H2O弱
(3)元素甲是第三周期ⅦA族元素,甲元素与另两种非金属元素可组成离子化合物A.写出A的电子式
(4)氮和氧都是较活泼的非金属元素,用一个化学方程式说明两种单质的氧化性强弱
(5)在所有元素的气态氢化物中,元素乙的氢化物最稳定,写出元素乙的单质与水反应的化学方程式
(6)0.1mol的单质Cl2与100mL1.5mol/L的FeBr2溶液反应,则被氧化的Fe2+和Br-的物质的量之比是
X、Y、Z三种短周期元素,原子序数依次增大,其最外层电子数之和为15,它们分别是所在周期最活泼的金属或非金属元素。其中Y元素的单质在空气中可形成两种氧化物,其阴、阳离子个数比均为1∶2。另有一常见金属W与常温下为液态的化合物A在一定条件下可发生如下变化
请完成下列问题:
(1)X、Y、Z三种元素的离子半径由大到小的顺序为____________(用离子符号表示)。
(2)X、Z及第VIA族第一种元素的氢化物的沸点由高到低的顺序为__________(用氢化物的分子式表示)。
(3)Y元素最高价氧化物对应水化物的电子式为________________________。
(4)W与Z的单质在一定条件下剧烈反应生成一种棕黄色的固体,将该固体溶于水得一黄色溶液,写出检验该溶液中金属离子的离子方程式(写一个)_____________________。
(5)B为黑色固体,在上述变化中,生成1molB转移电子_________________mol。
(6)以(4)中的黄色溶液为电解质,W及另一种材料为电极构成原电池,5分钟后,W减轻10g,则另一种材料为_________,电池总反应为________________________。
查看习题详情和答案>>
(1)X、Y、Z三种元素的离子半径由大到小的顺序为____________(用离子符号表示)。
(2)X、Z及第VIA族第一种元素的氢化物的沸点由高到低的顺序为__________(用氢化物的分子式表示)。
(3)Y元素最高价氧化物对应水化物的电子式为________________________。
(4)W与Z的单质在一定条件下剧烈反应生成一种棕黄色的固体,将该固体溶于水得一黄色溶液,写出检验该溶液中金属离子的离子方程式(写一个)_____________________。
(5)B为黑色固体,在上述变化中,生成1molB转移电子_________________mol。
(6)以(4)中的黄色溶液为电解质,W及另一种材料为电极构成原电池,5分钟后,W减轻10g,则另一种材料为_________,电池总反应为________________________。
X、Y、Z三种短周期元素,原子序数依次增大,其最外层电子数之和为15,它们分别是所在周期最活泼的金属或非金属元素.其中Y元素的单质在空气中可形成两种氧化物,其阴、阳离子个数比均为1:2.另有一常见金属W与常温下为液态的化合物A在一定条件下可发生如下变化:

请完成下列问题:
(1)、X、Y、Z三种元素的离子半径由大到小的顺序为 (用离子符号表示).
(2)、X、Z及第VIA族第一种元素的氢化物的沸点由高到低的顺序为 (用氢化物的分子式表示).
(3)、Y元素最高价氧化物对应水化物的电子式为 .
(4)、W与Z的单质在一定条件下剧烈反应生成一种棕黄色的固体,将该固体溶于水得一黄色溶液,写出检验该溶液中金属离子的离子方程式(写一个) .
(5)、B为黑色固体,在上述变化中,生成1molB转移电子 mol.
(6)、以(4)中的黄色溶液为电解质,W及另一种材料为电极构成原电池,5分钟后,W减轻10g,则另一种材料为 ,电池总反应为 . 查看习题详情和答案>>

请完成下列问题:
(1)、X、Y、Z三种元素的离子半径由大到小的顺序为 (用离子符号表示).
(2)、X、Z及第VIA族第一种元素的氢化物的沸点由高到低的顺序为 (用氢化物的分子式表示).
(3)、Y元素最高价氧化物对应水化物的电子式为 .
(4)、W与Z的单质在一定条件下剧烈反应生成一种棕黄色的固体,将该固体溶于水得一黄色溶液,写出检验该溶液中金属离子的离子方程式(写一个) .
(5)、B为黑色固体,在上述变化中,生成1molB转移电子 mol.
(6)、以(4)中的黄色溶液为电解质,W及另一种材料为电极构成原电池,5分钟后,W减轻10g,则另一种材料为 ,电池总反应为 . 查看习题详情和答案>>