题目内容
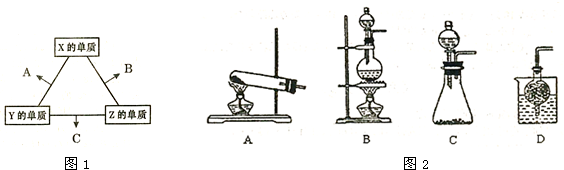
X、Y、Z三种短周期元素,原子序数依次增大,其最外层电子数之和为15,它们分别是所在周期最活泼的金属或非金属元素.其中Y元素的单质在空气中可形成两种氧化物,其阴、阳离子个数比均为1:2.另有一常见金属W与常温下为液态的化合物A在一定条件下可发生如下变化:

请完成下列问题:
(1)、X、Y、Z三种元素的离子半径由大到小的顺序为
(2)、X、Z及第VIA族第一种元素的氢化物的沸点由高到低的顺序为
(3)、Y元素最高价氧化物对应水化物的电子式为
 .
.
(4)、W与Z的单质在一定条件下剧烈反应生成一种棕黄色的固体,将该固体溶于水得一黄色溶液,写出检验该溶液中金属离子的离子方程式(写一个)
(5)、B为黑色固体,在上述变化中,生成1molB转移电子
(6)、以(4)中的黄色溶液为电解质,W及另一种材料为电极构成原电池,5分钟后,W减轻10g,则另一种材料为

请完成下列问题:
(1)、X、Y、Z三种元素的离子半径由大到小的顺序为
Cl-F-Na+
Cl-F-Na+
(用离子符号表示).(2)、X、Z及第VIA族第一种元素的氢化物的沸点由高到低的顺序为
HF、HCl
HF、HCl
(用氢化物的分子式表示).(3)、Y元素最高价氧化物对应水化物的电子式为


(4)、W与Z的单质在一定条件下剧烈反应生成一种棕黄色的固体,将该固体溶于水得一黄色溶液,写出检验该溶液中金属离子的离子方程式(写一个)
Fe3++3SCN??Fe(SCN)3或Fe3++3OH?=Fe(OH)3↓
Fe3++3SCN??Fe(SCN)3或Fe3++3OH?=Fe(OH)3↓
.(5)、B为黑色固体,在上述变化中,生成1molB转移电子
8
8
mol.(6)、以(4)中的黄色溶液为电解质,W及另一种材料为电极构成原电池,5分钟后,W减轻10g,则另一种材料为
石墨或铜
石墨或铜
,电池总反应为Fe+2Fe3+=3Fe2+或Fe+2FeCl3=3FeCl2
Fe+2Fe3+=3Fe2+或Fe+2FeCl3=3FeCl2
.分析:根据题意知,常见金属W,常见金属有铝、铁和铜,常温下为液态的化合物为水,所以A为水;水和常见金属在高温下能发生反应,能和水在高温下能反应是金属是铁,所以W是铁;铁和水在高温下生成氢气和四氧化三铁,四氧化三铁和氢气在高温下能反应生成铁和水;其中Y元素的单质在空气中可形成氧化物,其阴、阳离子个数比均为1:2,所以形成的氧化物中氧元素的化合价是-2价,所以Y元素的化合价是+1价,所以Y是第ⅠA元素,在空气中能形成离子化合物的第ⅠA族元素是钠元素;X、Y、Z三种短周期元素,原子序数依次增大,其最外层电子数之和为15,它们分别是所在周期最活泼的金属或非金属元素,所以z是氯元素;X、Y、Z三种短周期元素,原子序数依次增大,其最外层电子数之和为15,Y的最外层电子为1,Z的最外层电子数为7,所以X的最外层电子数为7,它们分别是所在周期最活泼的金属或非金属元素,所以X是氟元素.
(1)、根据元素周期律离子半径大小的比较判断.
(2)、根据氢化物沸点与分子量之间的关系判断,注意氢键对物质沸点的影响.
(3)、Y元素最高价氧化物对应水化物是氢氧化钠,氢氧化钠是离子化合物,写出其电子式.
(4)、铁与氯气在一定条件下剧烈反应生成一种棕黄色的固体氯化铁,将氯化铁溶于水得一黄色溶液氯化铁溶液,溶液中存在三价铁离子,检验三价铁离子可用硫氰化钾或氢氧化钠溶液.
(5)、铁与水蒸气反应生成四氧化三铁和氢气,B为黑色固体,所以B是四氧化三铁,根据四氧化三铁和转移电子之间的关系式计算.
(6)、先根据金属质量的变性判断铁作负极,再根据正极上发生的反应判断正极材料;根据正负极上发生的电极反应式写出电池反应式.
(1)、根据元素周期律离子半径大小的比较判断.
(2)、根据氢化物沸点与分子量之间的关系判断,注意氢键对物质沸点的影响.
(3)、Y元素最高价氧化物对应水化物是氢氧化钠,氢氧化钠是离子化合物,写出其电子式.
(4)、铁与氯气在一定条件下剧烈反应生成一种棕黄色的固体氯化铁,将氯化铁溶于水得一黄色溶液氯化铁溶液,溶液中存在三价铁离子,检验三价铁离子可用硫氰化钾或氢氧化钠溶液.
(5)、铁与水蒸气反应生成四氧化三铁和氢气,B为黑色固体,所以B是四氧化三铁,根据四氧化三铁和转移电子之间的关系式计算.
(6)、先根据金属质量的变性判断铁作负极,再根据正极上发生的反应判断正极材料;根据正负极上发生的电极反应式写出电池反应式.
解答:解:通过以上分析知,X、Y、Z分别是氟元素、钠元素、氯元素.
(1)电子层结构相同的离子,原子序数越大,离子半径越小,所以氟离子半径大于钠离子半径;同一主族元素,离子半径随着原子序数的增大而增大,所以氯离子的半径大于氟离子的半径,所以X、Y、Z三种元素的离子半径由大到小的顺序为Cl- F-Na+.
故答案为:Cl- F-Na+.
(2)气态氢化物的沸点随着其相对分子量的增大而增大,但氟化氢中含有氢键导致氟化氢的沸点大于氯化氢的沸点;故答案为:HF、HCl.
(3)氢氧化钠是离子化合物,存在的化学键有:钠离子和氢氧根离子之间存在离子键,氧原子和氢原子之间存在极性共价键,所以其电子式为: .
.
故答案为: .
.
(4)检验三价铁离子可用硫氰化钾或氢氧化钠溶液,无色的硫氰化钾溶液遇三价铁离子变成血红色,离子反应方程式为:Fe3++3SCN??Fe(SCN)3;或向氯化铁溶液中滴加氢氧化钠溶液有红褐色沉淀生成,离子反应方程式为:
Fe3++3OH?=Fe(OH)3↓.
故答案为:Fe3++3SCN??Fe(SCN)3或Fe3++3OH?=Fe(OH)3↓.
(5)铁和水蒸气反应的方程式为:3Fe+4H2O(g)
Fe3O4+4H2↑ 转移电子
1mol 8mol
1mol 8mol
故答案为:8.
(6)氯化铁溶液为电解质溶液组成原电池,W及另一种材料为电极构成原电池,5分钟后,W减轻10g,说明铁作负极,不如铁活泼的金属或导电的非金属作正极,可选石墨或铜;负极上铁失去电子发生氧化反应,正极上三价铁离子得电子发生还原反应,实际上是铁和三价铁离子发生氧化还原反应,所以电池反应式为:Fe+2Fe3+=3Fe2+或
Fe+2FeCl3=3FeCl2.
故答案为:石墨或铜;Fe+2Fe3+=3Fe2+或Fe+2FeCl3=3FeCl2.
(1)电子层结构相同的离子,原子序数越大,离子半径越小,所以氟离子半径大于钠离子半径;同一主族元素,离子半径随着原子序数的增大而增大,所以氯离子的半径大于氟离子的半径,所以X、Y、Z三种元素的离子半径由大到小的顺序为Cl- F-Na+.
故答案为:Cl- F-Na+.
(2)气态氢化物的沸点随着其相对分子量的增大而增大,但氟化氢中含有氢键导致氟化氢的沸点大于氯化氢的沸点;故答案为:HF、HCl.
(3)氢氧化钠是离子化合物,存在的化学键有:钠离子和氢氧根离子之间存在离子键,氧原子和氢原子之间存在极性共价键,所以其电子式为:
 .
.故答案为:
 .
.(4)检验三价铁离子可用硫氰化钾或氢氧化钠溶液,无色的硫氰化钾溶液遇三价铁离子变成血红色,离子反应方程式为:Fe3++3SCN??Fe(SCN)3;或向氯化铁溶液中滴加氢氧化钠溶液有红褐色沉淀生成,离子反应方程式为:
Fe3++3OH?=Fe(OH)3↓.
故答案为:Fe3++3SCN??Fe(SCN)3或Fe3++3OH?=Fe(OH)3↓.
(5)铁和水蒸气反应的方程式为:3Fe+4H2O(g)
| ||
1mol 8mol
1mol 8mol
故答案为:8.
(6)氯化铁溶液为电解质溶液组成原电池,W及另一种材料为电极构成原电池,5分钟后,W减轻10g,说明铁作负极,不如铁活泼的金属或导电的非金属作正极,可选石墨或铜;负极上铁失去电子发生氧化反应,正极上三价铁离子得电子发生还原反应,实际上是铁和三价铁离子发生氧化还原反应,所以电池反应式为:Fe+2Fe3+=3Fe2+或
Fe+2FeCl3=3FeCl2.
故答案为:石墨或铜;Fe+2Fe3+=3Fe2+或Fe+2FeCl3=3FeCl2.
点评:本题考查了元素化合物的推断、三价铁离子的检验、电极反应式的书写、电子式的书写等知识点,综合性较强,明确二价铁离子和三价铁离子的检验方法.

练习册系列答案
相关题目