摘要:26.已知:A.B.D.E为四种短周期元素.它们的核电荷数A<B<D<E,A与B可生成共价化合物AB2.每个AB2分子中含有22个电子,D元素与A元素为同主族元素.E元素原子的最外层电子数比次外层少1个.试回答下列下列问题: (1)写出AB2的电子式 , (2)写出A与E形成的共价化合物的结构式 , (3)写出E-的结构示意图 , (4)D元素和B元素也能形成DB2型共价化合物.但它与AB2相比.在物理性质却有着巨大反差.请你从结构上给予合理的解释 .
网址:http://m.1010jiajiao.com/timu3_id_170789[举报]
已知:①A、B、C、G为四种单质,常温下A、B、G是气体,C为固体;
②C、H、I、M含有同一种元素;
③D、K、L是气态化合物,其中D极易溶于水,L能溶于水,而K难溶于水;
④F是一种无色液体;
⑤M的焰色反应呈黄色。
这几种物质间的转化关系如下图所示:
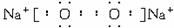
请填写以下空白:
(1)写出化合物D、J的化学式:D____________,J____________。
(2)化合物I的电子式:____________,L的分子的空间构型:____________。
(3)写出反应①的化学方程式:________________________;写出反应②的离子方程式:________________________。
(4)反应②用于工业生产时,目前采用的比较先进的技术是____________,从安全方面考虑它可防止________________________。
查看习题详情和答案>> A、B、C、D、E、F是中学化学教材中六种常见的物质,它们之间有如图所示的相互转化关系(反应条件及部分产物未标出).
A、B、C、D、E、F是中学化学教材中六种常见的物质,它们之间有如图所示的相互转化关系(反应条件及部分产物未标出).请回答下列问题:
已知:A、B、D均是有机物,其中A、B是家庭厨房中常用调味品的主要成分,且B的相对分子质量比A大14,E是密度最小的气体,则F为
钠
钠
(填名称),A中所含官能团的名称是羟基
羟基
,反应①的化学方程式为CH3COOH+C2H5OH CH3COOC2H5+H2O
CH3COOC2H5+H2O
 CH3COOC2H5+H2O
CH3COOC2H5+H2OCH3COOH+C2H5OH CH3COOC2H5+H2O
CH3COOC2H5+H2O
. CH3COOC2H5+H2O
CH3COOC2H5+H2O(2012?河东区二模)A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的原子半径最小;B元素的最高价氧化物对应水化物与其氢化物能生成盐;D与A同主族,且与E同周期;E元素原子的最外层电子数是其次外层电子数的3/4,A、B、D、E这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物.请回答下列问题:
(1)元素D在周期表中的位置
 ;
;
(2)C和E两种元素相比较,非金属性较强的是(填元素符号)
A.比较这两种元素的常见单质是沸点
B.比较这两种元素的单质与氢气化合的难易
C.比较这两种元素的气态氢化物的稳定性
(3)A、C、E间可形成甲、乙两种粒子,它们均为负一价双原子阴离子,且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为
(4)①在火箭推进器中装有液态B2A4和液态A2C2,已知0.4mol液态B2A4和足量液态A2C2反应,生成气态B2和气态A2C,放出256.6kJ的热量.试写出该反应的热化学方程式:
②B2A4是一种可燃性液体,B2A4-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液,该电池放电时的负极反应式为:
查看习题详情和答案>>
(1)元素D在周期表中的位置
第三周期第IA族
第三周期第IA族
;B单质的电子式是

(2)C和E两种元素相比较,非金属性较强的是(填元素符号)
O
O
,可以验证该结论的起(填写编号)BC
BC
;A.比较这两种元素的常见单质是沸点
B.比较这两种元素的单质与氢气化合的难易
C.比较这两种元素的气态氢化物的稳定性
(3)A、C、E间可形成甲、乙两种粒子,它们均为负一价双原子阴离子,且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为
HSˉ+OHˉ=S2ˉ+H2O
HSˉ+OHˉ=S2ˉ+H2O
(4)①在火箭推进器中装有液态B2A4和液态A2C2,已知0.4mol液态B2A4和足量液态A2C2反应,生成气态B2和气态A2C,放出256.6kJ的热量.试写出该反应的热化学方程式:
N2H4(l)+2H2O2+(l)=N2(g)+4H2O(g)△H=-641.5kJ/mol
N2H4(l)+2H2O2+(l)=N2(g)+4H2O(g)△H=-641.5kJ/mol
.②B2A4是一种可燃性液体,B2A4-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液,该电池放电时的负极反应式为:
N2H4-4eˉ+4OHˉ=N2+4H2O
N2H4-4eˉ+4OHˉ=N2+4H2O
. Ⅰ、有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A元素的原子是半径最小的原子.B元素的最高价氧化物的水化物与其氢化物反应生成一种盐X,D与A同族,且与E同周期,E元素的最外层电子数是次外层电子数的
Ⅰ、有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A元素的原子是半径最小的原子.B元素的最高价氧化物的水化物与其氢化物反应生成一种盐X,D与A同族,且与E同周期,E元素的最外层电子数是次外层电子数的| 3 |
| 4 |
(1)写出相应元素符号,A
H
H
BN
N
CO
O
ES
S
(2)X溶液呈酸性,其原因是
NH4++H2O NH3?H2O+H+
NH3?H2O+H+
 NH3?H2O+H+
NH3?H2O+H+NH4++H2O NH3?H2O+H+
NH3?H2O+H+
(用离子方程式表示). NH3?H2O+H+
NH3?H2O+H+(3)由A、C、D、E四种元素所组成的一种中学常见的化合物,它既能与盐酸反应,又能与NaOH溶液反应,在这种化合物的水溶液中,滴入紫色石蕊试液出现红色,则溶液中离子浓度由大到小的排列顺序为:
c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)
c(Na+)>c(HSO3-)>c(H+)>c(SO32-)>c(OH-)
.(4)A2C2能使酸性KMnO4溶液褪色,该反应的离子方程式为
2MnO4-+5H2O2+6H+=2Mn2++5O2+8H2O
2MnO4-+5H2O2+6H+=2Mn2++5O2+8H2O
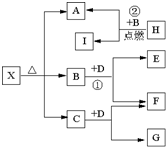
.Ⅱ、已知X是一种盐,H是常见金属单质,F、I是常见非金属单质,E、G都是工业上重要的碱性物质,它们有如图所示的关系.试回答下列问题
(1)X、G的化学式分别为:
Mg(HCO3)2
Mg(HCO3)2
、NaOH
NaOH
.(2)B的结构式为
O=C=O
O=C=O
.(3)写出下列反应的化学方程式①
2Na2O2+2CO2=2Na2CO3+O2
2Na2O2+2CO2=2Na2CO3+O2
②2Mg+CO2
2MgO+C
| ||
2Mg+CO2
2MgO+C
.
| ||
(2012?湖南模拟)已知:A、B、D为中学常见的单质,甲、乙、丙、丁、戊为短周期元素组成的化合物.其中,丙是一种能使湿润的红色石蕊试纸变蓝的无色气体;丁是一种高能燃料,其组成元素与丙相同,1mol丁分子中不同原子的数目比为1:2,且含有18mol电子;戊是一种难溶于水的白色胶状物质,既能与强酸反应,也能与强碱反应,具有净水作用.各物质间的转化关系如图所示(某些条件已略去).
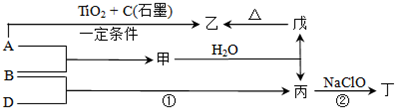
请回答:
(1)单质B的组成元素在周期表中的位置是
(2)戊的化学式为
(3)丙中所包含的化学键类型有
a.离子键 b.极性共价键 c.非极性共价键
(4)反应①的化学方程式为
(5)反应②中,0.5mol NaClO参加反应时,转移1mol 电子,其化学方程式为:
(6)一定条件下,A与TiO2、C(石墨)反应只生成乙和碳化钛(TiC),二者均为某些高温结构陶瓷的主要成分.已知,该反应生成1mol乙时放出536kJ热量,其热化学方程式为
查看习题详情和答案>>

请回答:
(1)单质B的组成元素在周期表中的位置是
第2周期第VA族
第2周期第VA族
.(2)戊的化学式为
Al(OH)3
Al(OH)3
.(3)丙中所包含的化学键类型有
b
b
(填字母序号).a.离子键 b.极性共价键 c.非极性共价键
(4)反应①的化学方程式为
N2+3H2
2NH3
| ||
| 高温高压 |
N2+3H2
2NH3
.
| ||
| 高温高压 |
(5)反应②中,0.5mol NaClO参加反应时,转移1mol 电子,其化学方程式为:
2NH3+NaClO═N2H4+NaCl+H2O
2NH3+NaClO═N2H4+NaCl+H2O
.(6)一定条件下,A与TiO2、C(石墨)反应只生成乙和碳化钛(TiC),二者均为某些高温结构陶瓷的主要成分.已知,该反应生成1mol乙时放出536kJ热量,其热化学方程式为
4Al(s)+3TiO2(s)+3C(s,石墨)═2Al2O3(s)+3TiC(s)△H=-1072kJ/mol
4Al(s)+3TiO2(s)+3C(s,石墨)═2Al2O3(s)+3TiC(s)△H=-1072kJ/mol
.