摘要:23某研究性学习小组设计了如下图所示的实验.以此来验证氯.溴.碘三种卤素单质的氧化性顺序.图中A. B. C分别是浸有饱和溴化钠溶液.饱和碘化钾溶液.淀粉水溶液的棉球.烧杯D中盛有氢氧化钠溶液.实验时从左端导管口缓慢通入氯气.待A处出现明显现象而B没有变化时.停止通入氯气. 再依次对A.B棉球进行加热.请利用资料卡片提供的信息.结合所学知识.完成下列问题: D 资料卡片 卤素 单质 颜色和状态 蒸气颜色 在水中的溶解度 水溶液的颜色 熔点 /℃ 沸点 /℃ Cl2 黄绿色气体 黄绿色 从Cl2→I2在一定量水中溶解的物质的量逐渐减少 淡黄绿色 -101 -34.6 Br2 深红棕色液体 红棕色 橙红色 -7.2 58.78 I2 紫黑色固体 紫色 黄褐色 113.5 184.4 (1)棉球A的现象: (2)棉球B上反应的化学方程式: 若反应中有0.1mol的电子转移.被氧化的物质的物质的量是 (3)棉球C的现象: 23厦门市集美区某企业的一个储氯罐某日发生液氯泄漏事故.如果你是该企业管理者.又恰好在现场.你当如何处置?(至少答出四点合理的处置意见)
网址:http://m.1010jiajiao.com/timu3_id_170711[举报]
某化学研究性学习小组通过查阅资料,设计了如图所示的方法以含镍废催化剂为原料来制备NiSO4?7H2O.已知某化工厂的含镍催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).

部分阳离子以氢氧化物形式完全沉淀时的pH如下:
回答下列问题:
(1)操作a、c中需使用的仪器除铁架台(带铁圈)、酒精灯、烧杯、玻璃棒外还需要的主要仪器为______.
(2)“碱浸”过程中发生的离子方程式是______.
(3)“酸浸”时所加入的酸是______(填化学式).酸浸后,经操作a分离出固体①后,溶液中可能含有的金属离子是______.
(4)操作b为调节溶液的pH,你认为pH的最佳调控范围是______.
(5)“调pH为2~3”的目的是______.
(6)产品晶体中有时会混有少量绿矾,其原因可能是______.
查看习题详情和答案>>

部分阳离子以氢氧化物形式完全沉淀时的pH如下:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 9.2 |
(1)操作a、c中需使用的仪器除铁架台(带铁圈)、酒精灯、烧杯、玻璃棒外还需要的主要仪器为______.
(2)“碱浸”过程中发生的离子方程式是______.
(3)“酸浸”时所加入的酸是______(填化学式).酸浸后,经操作a分离出固体①后,溶液中可能含有的金属离子是______.
(4)操作b为调节溶液的pH,你认为pH的最佳调控范围是______.
(5)“调pH为2~3”的目的是______.
(6)产品晶体中有时会混有少量绿矾,其原因可能是______.
查看习题详情和答案>>
(2010?南通模拟)某化学研究性学习小组通过查阅资料,设计了如图所示的方法以含镍废催化剂为原料来制备NiSO4?7H2O.已知某化工厂的含镍催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).

部分阳离子以氢氧化物形式完全沉淀时的pH如下:
回答下列问题:
(1)操作a、c中需使用的仪器除铁架台(带铁圈)、酒精灯、烧杯、玻璃棒外还需要的主要仪器为
(2)“碱浸”过程中发生的离子方程式是
(3)“酸浸”时所加入的酸是
(4)操作b为调节溶液的pH,你认为pH的最佳调控范围是
(5)“调pH为2~3”的目的是
(6)产品晶体中有时会混有少量绿矾(FeSO4?7H2O),其原因可能是
查看习题详情和答案>>

部分阳离子以氢氧化物形式完全沉淀时的pH如下:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 9.2 |
(1)操作a、c中需使用的仪器除铁架台(带铁圈)、酒精灯、烧杯、玻璃棒外还需要的主要仪器为
漏斗、蒸发皿
漏斗、蒸发皿
.(2)“碱浸”过程中发生的离子方程式是
2Al+2OH-+2H2O═2AlO2-+3H2↑、Al2O3+2OH-═2AlO2-+3H2O
2Al+2OH-+2H2O═2AlO2-+3H2↑、Al2O3+2OH-═2AlO2-+3H2O
.(3)“酸浸”时所加入的酸是
H2SO4
H2SO4
(填化学式).酸浸后,经操作a分离出固体①后,溶液中可能含有的金属离子是Ni2+、Fe2+
Ni2+、Fe2+
.(4)操作b为调节溶液的pH,你认为pH的最佳调控范围是
3.2-9.2
3.2-9.2
.(5)“调pH为2~3”的目的是
防止在浓缩结晶过程中Ni2+水解
防止在浓缩结晶过程中Ni2+水解
.(6)产品晶体中有时会混有少量绿矾(FeSO4?7H2O),其原因可能是
H2O2的用量不足(或H2O2失效)、保温时间不足导致Fe2+未被完全氧化造成的
H2O2的用量不足(或H2O2失效)、保温时间不足导致Fe2+未被完全氧化造成的
.(14分)某化学研究性学习小组通过查阅资料,设计了如下图所示的方法以含镍废催化剂为原料来制备NiSO4?7H2O。已知某化工厂的含镍催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%)。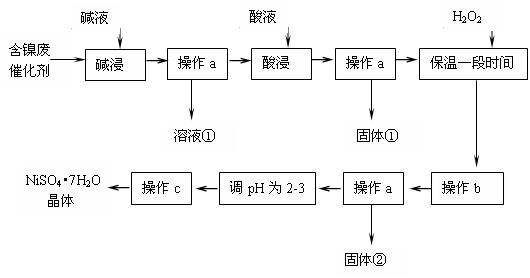
部分阳离子以氢氧化物形式完全沉淀时的pH如下:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 9.2 |
⑴操作a、c中需使用的仪器除铁架台(带铁圈)、酒精灯、烧杯、玻璃棒外还需要的主要仪器为 。
⑵“碱浸”过程中发生的离子方程式是 。
⑶“酸浸”时所加入的酸是 (填化学式)。酸浸后,经操作a分离出固体①后,溶液中可能含有的金属离子是 。
⑷操作b为调节溶液的pH,你认为pH的最佳调控范围是 。
⑸“调pH为2~3”的目的是 。
⑹产品晶体中有时会混有少量绿矾(FeSO4·7H2O),其原因可能是 。 查看习题详情和答案>>
(14分)某化学研究性学习小组通过查阅资料,设计了如下图所示的方法以含镍废催化剂为原料来制备NiSO4?7H2O。已知某化工厂的含镍催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%)。
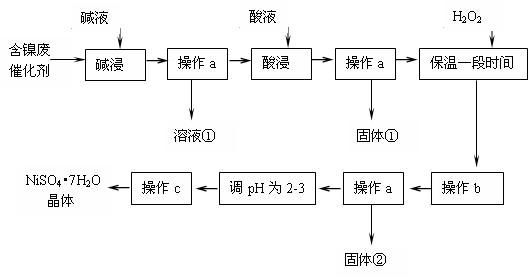
部分阳离子以氢氧化物形式完全沉淀时的pH如下:
回答下列问题:
⑴操作a、c中需使用的仪器除铁架台(带铁圈)、酒精灯、烧杯、玻璃棒外还需要的主要仪器为 。
⑵“碱浸”过程中发生的离子方程式是 。
⑶“酸浸”时所加入的酸是 (填化学式)。酸浸后,经操作a分离出固体①后,溶液中可能含有的金属离子是 。
⑷操作b为调节溶液的pH,你认为pH的最佳调控范围是 。
⑸“调pH为2~3”的目的是 。
⑹产品晶体中有时会混有少量绿矾(FeSO4·7H2O),其原因可能是 。

部分阳离子以氢氧化物形式完全沉淀时的pH如下:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 9.2 |
⑴操作a、c中需使用的仪器除铁架台(带铁圈)、酒精灯、烧杯、玻璃棒外还需要的主要仪器为 。
⑵“碱浸”过程中发生的离子方程式是 。
⑶“酸浸”时所加入的酸是 (填化学式)。酸浸后,经操作a分离出固体①后,溶液中可能含有的金属离子是 。
⑷操作b为调节溶液的pH,你认为pH的最佳调控范围是 。
⑸“调pH为2~3”的目的是 。
⑹产品晶体中有时会混有少量绿矾(FeSO4·7H2O),其原因可能是 。
某化工厂的含镍废催化剂主要含Ni,还含有Al、Al2O3、Fe、FeO、Fe2O3及其他不溶杂质(其他不溶杂质不与酸碱反应)。某校化学研究性学习小组设计了如下图所示的方法,以该含镍废催化剂为原料来制备NiSO4·7H2O。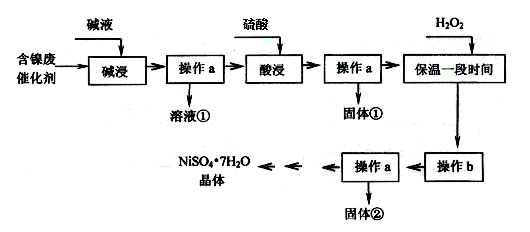
【查阅资料】
①Ni能与非氧化性酸反应生成Ni2+,不与碱液反应。
②部分阳离子以氢氧化物形式沉淀时pH如下:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 4.1 | 1.7 | 7.6 | 7.0 |
| 完全沉淀的pH | 5.2 | 3.2 | 9.5 | 9.2 |
(1)操作a为 。
(2)“碱浸”的目的是除去 (填化学式)。
(3)操作b为调节溶液的pH,你认为pH的最佳调控范围是 。
(4)NiSO4在强碱溶液中用次氯酸钠氧化,可以制得碱性镍氢电池电极材料NiOOH。
①写出该反应的离子方程式 。
②已知碱性镍氢电池总反应: H2+2NiOOH
 2Ni(OH)2,写出该反应放电时正极反应式 。
2Ni(OH)2,写出该反应放电时正极反应式 。(5)一般认为残留在溶液中的离子浓度小于1.0×10-5 mol·L-1时,沉淀已经完全。请利用上表中数据估算Fe(OH)2的溶度积
 。
查看习题详情和答案>>
。
查看习题详情和答案>>