网址:http://m.1010jiajiao.com/timu3_id_170186[举报]
实验室要配制1mol/L的稀硫酸250mL,回答下列问题:
① 需要98%密度为1.84g/cm3的浓硫酸 mL。
② 配制时,必须使用的仪器除 20 mL量筒, 250 mL容量瓶,玻璃棒外,还需要的仪器有 。
③ 配制时,该实验两次用到玻璃棒,其作用分别是 、 。
④ 配制过程中出现以下情况,对所配溶液浓度有何影响(填“偏高”、“偏低”或“不影响”)没有洗涤烧杯和玻璃棒 ;容量瓶没有干燥 。
(2)用如下图所示装置(夹持仪器省略,暂不考虑尾气的吸收)进行实验,将液体A逐滴加入到固体B中,回答下列问题:
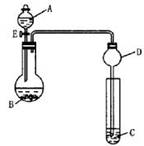
① 如何检验该装置的气密性 。
② 若A为30%H2O2溶液,B为MnO2,C盛有氢硫酸(H2S)饱和溶液,旋开E后,C中的现象为________________ ;B中发生反应的化学方程式为_____________ 。
③ 若A为浓盐酸,B为KMnO4,C中盛有KI淀粉溶液,旋开E后,C中的现象是___________________ ;B中发生反应的离子方程式为_________________ 。
④ 图中D装置在实验中的作用是____________________________ 。
查看习题详情和答案>>树德中学某化学兴趣小组在实验室用MnO2与浓盐酸反应制备C12(发生装置如图所示)。
(1)制备实验开始时,先检查装置气密性,接下来的操作依次是 序号)。
A.往烧瓶中加入浓盐酸
B.加热
C.往烧瓶中加入MnO2粉末
(2)制备反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,兴趣小组同学提出下列实验探究方案:
甲方案:与足量AgNO3溶液反应,称量生成的AgCl质量
乙方案:采用酸碱恰好中和(有指示剂)的方法测定
丙方案:与已知量CaCO3(过量)反应,称量剩余的CaCO3质量
丁方案:与足量Zn反应,测量生成的H2体积(换算为标准状况)
继而进行下列判断和实验:
①判定甲方案是否可行 (填“是”或“否”),理由是 。
②进行乙方案实验:准确量取残余清液稀释一定倍数后作为试样。
a.量取试样20.00 mL,滴入0.200 0 mol/L的NaOH溶液,消耗NaOH溶液22.00 mL,该次测得试样中盐酸浓度为 mol·L一1;
b.重复以上操作多次取平均值获得实验结果
③判断丙方案的实验结果 (填“偏大"、“偏小”或“准确”)。
(已知:部分CaCO3会转化为更难溶的MnCO3)
④进行丁方案实验:装置如图所示(夹持器具已略去)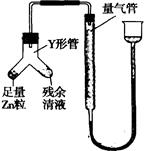
(i)使Y形管中的残余清液与锌粒反应的正确操作是将 转移到 中。
(ii)反应完毕,每间隔l分钟读取气体体积,气体体积逐次减小,直至不变。气体体积逐次减小的原因是 (排除仪器和实验操作的影响因素)
Ⅰ.实验室可用二氧化锰和浓盐酸反应制取氯气,反应的化学方程式是
| ||
| ||
Ⅱ.某研究性学习小组查阅资料得知,漂白粉与硫酸反应可制取氯气,化学方程式为:
Ca(ClO)2+CaCl2+2H2SO4
| ||
他们利用该反应设计如下制取氯气并验证其性质的实验.
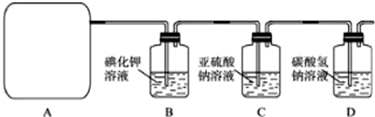
回答下列问题:
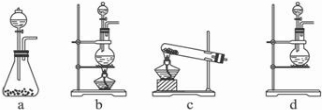
(1)该实验中A部分的装置是
(2)请你帮助他们设计一个实验,证明洗气瓶C中的Na2SO3已被氧化(简述实验步骤):
(3)写出D装置中发生反应的离子方程式
(4)该实验存在明显的缺陷,请你提出改进的方法
(5)该小组又进行了如下实验:称取漂白粉2.0g,研磨后溶解,配制成250mL溶液,取出25mL加入到锥形瓶中,再加入过量的KI溶液和过量的H2SO4溶液,静置.待完全反应后,用0.1mol?L-1的Na2S2O3溶液作标准液滴定反应生成的碘,已知反应方程式为:2Na2S2O3+I2═Na2S4O6+2NaI,共用去Na2S2O3溶液20.0mL.则该漂白粉中Ca(ClO)2的质量分数为
5KCl+KClO3+3H2O。

请回答下列问题:
(1)B中的液体是________,其作用是________________________________________;
(2)已知C杯中装的是水,D管内装的是15mL30%KOH溶液,这种水浴加热方法的优点是________________,通过什么现象可以观察到KOH基本反应完毕___________________
__________________。
(3)E处管口塞着一团棉纱(已用Na2S2O3溶液浸湿),作用是利用其还原性吸收多余的Cl2,反应的离子方程式为________________________。
(4)已知KCl和KClO3在水中的溶解度如下表:
温度/℃ 0 20 40 60 80 100
KCl/℃ 27.6 34 40 45 51.1 56.7
KclO3/g 3.3 7 14 24.5 38.5 57
待D管内KOH基本反应完时,取所得混合溶液直接加热浓缩,则首先从溶液中析出的晶体是________________,当蒸发适量水后,趁热过滤,然后将滤液冷却,这时析出的晶体主要是________________________,欲进一步提纯KClO3,应采用的方法是________________
____________________。
查看习题详情和答案>>
实验室制KClO3,可利用下图装置。实验中的化学原理是利用MnO2和浓盐酸制得氯气,然后使氯气与热的KOH溶液(约70℃)反应制KClO3,其化学方程式为:3Cl2+6KOH![]()
5KCl+KClO3+3H2O。

请回答下列问题:
(1)B中的液体是________,其作用是________________________________________;
(2)已知C杯中装的是水,D管内装的是15mL30%KOH溶液,这种水浴加热方法的优点是________________,通过什么现象可以观察到KOH基本反应完毕___________________
__________________。
(3)E处管口塞着一团棉纱(已用Na2S2O3溶液浸湿),作用是利用其还原性吸收多余的Cl2,反应的离子方程式为________________________。
(4)已知KCl和KClO3在水中的溶解度如下表:
温度/℃ 0 20 40 60 80 100
KCl/℃ 27.6 34 40 45 51.1 56.7
KclO3/g 3.3 7 14 24.5 38.5 57
待D管内KOH基本反应完时,取所得混合溶液直接加热浓缩,则首先从溶液中析出的晶体是________________,当蒸发适量水后,趁热过滤,然后将滤液冷却,这时析出的晶体主要是________________________,欲进一步提纯KClO3,应采用的方法是________________
____________________。
查看习题详情和答案>>