题目内容
氯气是一种重要的工业原料.
Ⅰ.实验室可用二氧化锰和浓盐酸反应制取氯气,反应的化学方程式是
Ⅱ.某研究性学习小组查阅资料得知,漂白粉与硫酸反应可制取氯气,化学方程式为:
Ca(ClO)2+CaCl2+2H2SO4
2CaSO4+2Cl2↑+2H2O
他们利用该反应设计如下制取氯气并验证其性质的实验.
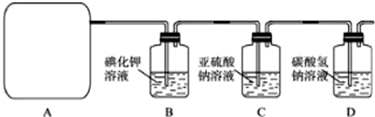
回答下列问题:
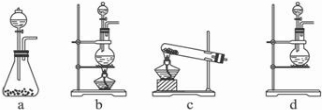
(1)该实验中A部分的装置是
(2)请你帮助他们设计一个实验,证明洗气瓶C中的Na2SO3已被氧化(简述实验步骤):
(3)写出D装置中发生反应的离子方程式
(4)该实验存在明显的缺陷,请你提出改进的方法
(5)该小组又进行了如下实验:称取漂白粉2.0g,研磨后溶解,配制成250mL溶液,取出25mL加入到锥形瓶中,再加入过量的KI溶液和过量的H2SO4溶液,静置.待完全反应后,用0.1mol?L-1的Na2S2O3溶液作标准液滴定反应生成的碘,已知反应方程式为:2Na2S2O3+I2═Na2S4O6+2NaI,共用去Na2S2O3溶液20.0mL.则该漂白粉中Ca(ClO)2的质量分数为
Ⅰ.实验室可用二氧化锰和浓盐酸反应制取氯气,反应的化学方程式是
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
| ||
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
.
| ||
Ⅱ.某研究性学习小组查阅资料得知,漂白粉与硫酸反应可制取氯气,化学方程式为:
Ca(ClO)2+CaCl2+2H2SO4
| ||
他们利用该反应设计如下制取氯气并验证其性质的实验.

回答下列问题:
(1)该实验中A部分的装置是
b
b
(填标号).
(2)请你帮助他们设计一个实验,证明洗气瓶C中的Na2SO3已被氧化(简述实验步骤):
取少量溶液置于洁净的试管中,向其中滴加稀盐酸至不再产生气体,再向其中滴入氯化钡溶液,若产生白色沉淀,证明亚硫酸钠被氧化
取少量溶液置于洁净的试管中,向其中滴加稀盐酸至不再产生气体,再向其中滴入氯化钡溶液,若产生白色沉淀,证明亚硫酸钠被氧化
.(3)写出D装置中发生反应的离子方程式
Cl2+H2O═H++Cl-+HClO;H++HCO3-═CO2↑+H2O
Cl2+H2O═H++Cl-+HClO;H++HCO3-═CO2↑+H2O
.(4)该实验存在明显的缺陷,请你提出改进的方法
应将尾气通入NaOH溶液中
应将尾气通入NaOH溶液中
.(5)该小组又进行了如下实验:称取漂白粉2.0g,研磨后溶解,配制成250mL溶液,取出25mL加入到锥形瓶中,再加入过量的KI溶液和过量的H2SO4溶液,静置.待完全反应后,用0.1mol?L-1的Na2S2O3溶液作标准液滴定反应生成的碘,已知反应方程式为:2Na2S2O3+I2═Na2S4O6+2NaI,共用去Na2S2O3溶液20.0mL.则该漂白粉中Ca(ClO)2的质量分数为
35.75%
35.75%
.分析:Ⅰ.二氧化锰和浓盐酸反应制取氯气、氯化锰和水,以此书写化学方程式;
Ⅱ.(1)根据反应物的状态及反应条件选择发生装置;
(2)氯气有强氧化性,亚硫酸根离子有还原性,所以氯气和亚硫酸根离子能发生氧化还原反应生成硫酸根离子、氯离子和氢离子;如果亚硫酸钠被氧化会生成硫酸钠,根据硫酸根离子的检验方法检验即可;
(3)氯气和水反应生成盐酸和次氯酸,盐酸能和碳酸氢根离子反应生成二氧化碳;
(4)氯气有刺激性气味,尾气不能直接排空,要用尾气处理装置处理;
(5)可利用关系式计算.
Ⅱ.(1)根据反应物的状态及反应条件选择发生装置;
(2)氯气有强氧化性,亚硫酸根离子有还原性,所以氯气和亚硫酸根离子能发生氧化还原反应生成硫酸根离子、氯离子和氢离子;如果亚硫酸钠被氧化会生成硫酸钠,根据硫酸根离子的检验方法检验即可;
(3)氯气和水反应生成盐酸和次氯酸,盐酸能和碳酸氢根离子反应生成二氧化碳;
(4)氯气有刺激性气味,尾气不能直接排空,要用尾气处理装置处理;
(5)可利用关系式计算.
解答:解:Ⅰ.二氧化锰和浓盐酸反应制取氯气、氯化锰和水,反应的方程式为MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;
Ⅱ.(1)A部分用于制取Cl2,根据所给Cl2的生成反应的反应物状态和反应是否需要加热选择气体发生装置,应选属于“固+液
气”型的b,故答案为:b;
(2)Na2SO3氧化的产物为Na2SO4,确定存在SO42-即可证明Na2SO3已部分被氧化.检验时,应取C中溶液少许于洁净试管中,先加稀HCl至不再产生气体以排除SO32-的干扰,然后再加入BaCl2溶液,若产生白色沉淀,则证明Na2SO3已部分被氧化,
故答案为:取少量溶液置于洁净的试管中,向其中滴加稀盐酸至不再产生气体,再向其中滴入氯化钡溶液,若产生白色沉淀,证明亚硫酸钠被氧化;
(3)进入D的Cl2与水反应的离子方程式为Cl2+H2O?H++Cl-+HClO,HCl能与NaHCO3反应,离子方程式为H++HCO3-=CO2↑+H2O,HClO因酸性比H2CO3弱而不能与NaHCO3反应,故答案为:Cl2+H2O═H++Cl-+HClO;H++HCO3-═CO2↑+H2O;
(4)NaHCO3吸收Cl2的能力有限,应将尾气通入NaOH溶液中,故答案为:应将尾气通入NaOH溶液中;
(5)关系式Ca(ClO)2~2Cl2~2I2~4Na2S2O3,
n[Ca(ClO)2]=
n(Na2S2O3)=20.0 mL×10-3 L?mL-1×0.1 mol?L-1×
×
=0.005 mol,
Ca(ClO)2%=
×100%=35.75%,
故答案为:35.75%.
| ||
故答案为:MnO2+4HCl(浓)
| ||
Ⅱ.(1)A部分用于制取Cl2,根据所给Cl2的生成反应的反应物状态和反应是否需要加热选择气体发生装置,应选属于“固+液
| ||
(2)Na2SO3氧化的产物为Na2SO4,确定存在SO42-即可证明Na2SO3已部分被氧化.检验时,应取C中溶液少许于洁净试管中,先加稀HCl至不再产生气体以排除SO32-的干扰,然后再加入BaCl2溶液,若产生白色沉淀,则证明Na2SO3已部分被氧化,
故答案为:取少量溶液置于洁净的试管中,向其中滴加稀盐酸至不再产生气体,再向其中滴入氯化钡溶液,若产生白色沉淀,证明亚硫酸钠被氧化;
(3)进入D的Cl2与水反应的离子方程式为Cl2+H2O?H++Cl-+HClO,HCl能与NaHCO3反应,离子方程式为H++HCO3-=CO2↑+H2O,HClO因酸性比H2CO3弱而不能与NaHCO3反应,故答案为:Cl2+H2O═H++Cl-+HClO;H++HCO3-═CO2↑+H2O;
(4)NaHCO3吸收Cl2的能力有限,应将尾气通入NaOH溶液中,故答案为:应将尾气通入NaOH溶液中;
(5)关系式Ca(ClO)2~2Cl2~2I2~4Na2S2O3,
n[Ca(ClO)2]=
| 1 |
| 4 |
| 250mL |
| 25mL |
| 1 |
| 4 |
Ca(ClO)2%=
| 0.005mol×143g/mol |
| 2.0g |
故答案为:35.75%.
点评:本题考查较为综合,题目难度中等,注意亚硫酸根离子的检验首先要排除硫酸根离子的干扰,易错点为(5),注意根据关系式法计算.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
氯气是一种重要的工业原料.工业上利用反应在3Cl2+2NH3=N2+6HCl检查氯气管道是否漏气.下列说法错误的是( )
| A、若管道漏气遇氨就会产生白烟 | B、该反应利用了Cl2的强氧化性 | C、该反应属于复分解反应 | D、生成1molN2有3mol电子转移 |
氯气是一种重要的工业原料.工业上利用反应在3Cl2+2NH3=N2+6HCl检查氯气管道是否漏气.下列说法错误的是( )
| A、若管道漏气遇氨就会产生白烟 | B、该反应利用了Cl2的强氧化性 | C、该反应属于置换反应 | D、生成1mol N2有12mol电子转移 |