摘要:8.7g MnO2与20m L 10mol.L-1浓盐酸共热.生成Cl2的质量为 A.7.1g B.3.55g C.小于3.55g D.大于3.55g
网址:http://m.1010jiajiao.com/timu3_id_170162[举报]
某化学兴趣小组欲在实验室探究氯气的性质及模拟工业制取漂白粉,设计了如图装置进行实验(实验室制取氯气的反应为MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O):

请按要求回答下列问题:
(1)淀粉碘化钾溶液中观察到的现象是 ,反应的离子方程式 .
(2)若干燥的有色布条不褪色,湿润的有色布条褪色,则甲中盛放 (填名称).
(3)Cl2与石灰乳反应制取漂白粉的化学方程式为 .
(4)该兴趣小组用8.7g MnO2与足量的浓盐酸制备氯气,则理论上最多可制得标准状况下的Cl2 L.
查看习题详情和答案>>
| ||

请按要求回答下列问题:
(1)淀粉碘化钾溶液中观察到的现象是
(2)若干燥的有色布条不褪色,湿润的有色布条褪色,则甲中盛放
(3)Cl2与石灰乳反应制取漂白粉的化学方程式为
(4)该兴趣小组用8.7g MnO2与足量的浓盐酸制备氯气,则理论上最多可制得标准状况下的Cl2
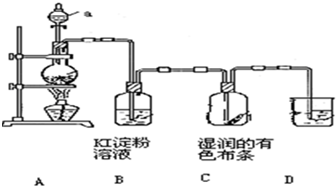 某化学研究性学习小组设计制取氯气及探究其性质的方案,并按下图所示装置完成实验.(A中发生反应的化学方程式为:MnO2+4HCl(浓)═MnCl2+
某化学研究性学习小组设计制取氯气及探究其性质的方案,并按下图所示装置完成实验.(A中发生反应的化学方程式为:MnO2+4HCl(浓)═MnCl2+Cl2↑+2H2O).
(1)装置A中,仪器a的名称是
(2)装置B中无色溶液将变为
(3)装置C中湿润的有色布条
(4)为了吸收多余的氯气,防止造成空气污染,装置D中应盛放
(5)用8.7g MnO2与足量浓盐酸反应,被氧化的盐酸的物质的量为
(6)某同学查阅资料得知:高锰酸钾与浓盐酸在常温正好生反应也可以生成氯气(反应的化学方程式为:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O),该反应的氧化剂是
(7)如反应中转移了0.50mol电子,则产生的气体在标准状况下体积为
(8)若氯气泄漏,某同学用湿毛巾捂住鼻子防止中毒,有以下四种溶液可浸湿毛巾,它们分别是:①NaOH溶液 ②NaCl溶液 ③KBr溶液 ④NaHCO3溶液,正确选择是
实验室用如图装置来制取干燥纯净的氯气,回答相关问题:

(1)写出上述制取氯气的化学方应方程式 .
(2)C装置的作用是 .
(3)F装置的作用是(用离子方程式表示) .
(4)若用8.7g MnO2与100mL 11mol/L的浓盐酸(足量)反应制取氯气,在标准状况下,生成氯气的体积为(不考虑氯气在溶液中的溶解) L.
(5)将上述反应后的溶液加水稀释到500mL,向从中取出的50mL溶液中加入足量AgNO3溶液,生成沉淀的物质的量为 mol.
查看习题详情和答案>>

(1)写出上述制取氯气的化学方应方程式
(2)C装置的作用是
(3)F装置的作用是(用离子方程式表示)
(4)若用8.7g MnO2与100mL 11mol/L的浓盐酸(足量)反应制取氯气,在标准状况下,生成氯气的体积为(不考虑氯气在溶液中的溶解)
(5)将上述反应后的溶液加水稀释到500mL,向从中取出的50mL溶液中加入足量AgNO3溶液,生成沉淀的物质的量为