摘要:20 . . 21 . (2) . . . 原因 措施 (3) 22 (2) . (3) . . 四 (本小题包括4小题.共48分) 23 (2) . (3) (4) (5) (6) 24 . . . (2) (3) (4) (5) 25 A B C 26 27 (2) . . (3) (4) . .(5) (6) 高一化学下学期第三章测验题
网址:http://m.1010jiajiao.com/timu3_id_170042[举报]
在元素周期表的主族元素中,甲元素与乙、丙、丁三种元素上下紧密相邻或左右紧密相邻,丙元素的原子序数等于甲、乙两种元素的原子序数之和,四种元素原子的最外层电子数之和为20.下列说法不正确的是( )
查看习题详情和答案>>
实验室用固体烧碱配制500mL0.1000mol/L的NaOH溶液.
(1)需称量
(2)配制过程中,不需要的仪器(填写代号)
A、烧杯 B、量筒 C、玻璃棒D、1000mL容量瓶 E、漏斗 F、胶头滴管 G、500mL试剂瓶
(3)根据实验需要和(2)所列仪器判断,完成实验还缺少的仪器是
(4)下列各项中,在容量瓶上必须标明的是
①容量 ②刻度线 ③温度 ④压强 ⑤物质的量浓度 ⑥用于配制酸溶液或碱溶液
(5)试分析下列操作,对所配溶液的浓度有何影响.(用偏低、偏高、无影响填空).
①定容后,加盖、倒转、摇匀后,发现液面低于刻度线,又补加蒸馏水至刻度.则所配溶液的浓度:
②为加速固体溶解,微热烧杯溶液并不断搅拌.在未降至20℃时,就将溶液转移至容量瓶定容.所配溶液的浓度:
③转移前,容量瓶中含有少量蒸馏水.所配溶液的浓度:
查看习题详情和答案>>
(1)需称量
2.0
2.0
g烧碱,应放在烧杯
烧杯
(填仪器名称)中称量.(2)配制过程中,不需要的仪器(填写代号)
DE
DE
A、烧杯 B、量筒 C、玻璃棒D、1000mL容量瓶 E、漏斗 F、胶头滴管 G、500mL试剂瓶
(3)根据实验需要和(2)所列仪器判断,完成实验还缺少的仪器是
500mL容量瓶、托盘天平
500mL容量瓶、托盘天平
.(4)下列各项中,在容量瓶上必须标明的是
①②③
①②③
①容量 ②刻度线 ③温度 ④压强 ⑤物质的量浓度 ⑥用于配制酸溶液或碱溶液
(5)试分析下列操作,对所配溶液的浓度有何影响.(用偏低、偏高、无影响填空).
①定容后,加盖、倒转、摇匀后,发现液面低于刻度线,又补加蒸馏水至刻度.则所配溶液的浓度:
偏低
偏低
.②为加速固体溶解,微热烧杯溶液并不断搅拌.在未降至20℃时,就将溶液转移至容量瓶定容.所配溶液的浓度:
偏高
偏高
.③转移前,容量瓶中含有少量蒸馏水.所配溶液的浓度:
无影响
无影响
.固体碘化铵置于密闭容器中,加热至一定温度后恒温;容器中发生反应:
①NH4I(s)?NH3(g)+HI(g)
②2HI(g)?H2(g)+I2(g),测得平衡时c(H2)=0.5mol/L,反应①的平衡常数为20,
则下列结论正确的是( )
①NH4I(s)?NH3(g)+HI(g)
②2HI(g)?H2(g)+I2(g),测得平衡时c(H2)=0.5mol/L,反应①的平衡常数为20,
则下列结论正确的是( )
| A、固体碘化铵一定完全分解 | B、当固体碘化铵物质的量增大一倍,则在相同条件下,容器内压强也增大一倍 | C、平衡时HI分解率为40% | D、平衡时C(NH3)=5mol/L |
(2008?天津)Ⅰ.化学实验室制取气体的方法之一是将浓硫酸滴入浓盐酸中.请从下图中挑选所需仪器,在方框内画出用该方法制备、收集干燥氯化氢气体的装置简图,并在图中标明所用试剂.(仪器可重复使用,固定装置不必画出)
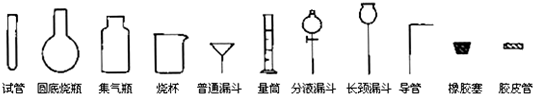
Ⅱ.实验室制备少量硫酸亚铁品体的实验步骤如下:取过量洁净的铁屑,加入20%~30%的稀硫酸溶液,在50℃~80℃水浴中加热至不再产生气泡.将溶液趁热过滤,滤液移至试管中,用橡胶塞塞紧试管口.静置、冷却一段时间后收集产品.
(1)写出该实验制备硫酸亚铁的化学方程式:
(2)硫酸溶液过稀会导致
(3)采用水浴加热的原因是
(4)反应时铁屑过量的目的是(用离子方程式表示)
(5)溶液趁热过滤的原因是
(6)静置冷却一段时间后,在试管中观察到的现象是
查看习题详情和答案>>

Ⅱ.实验室制备少量硫酸亚铁品体的实验步骤如下:取过量洁净的铁屑,加入20%~30%的稀硫酸溶液,在50℃~80℃水浴中加热至不再产生气泡.将溶液趁热过滤,滤液移至试管中,用橡胶塞塞紧试管口.静置、冷却一段时间后收集产品.
(1)写出该实验制备硫酸亚铁的化学方程式:
Fe+H2SO4=FeSO4+H2↑
Fe+H2SO4=FeSO4+H2↑
.(2)硫酸溶液过稀会导致
反应速率慢 不利于晶体析出
反应速率慢 不利于晶体析出
.(3)采用水浴加热的原因是
容易控制温度
容易控制温度
.(4)反应时铁屑过量的目的是(用离子方程式表示)
Fe+2Fe3+═3Fe2+
Fe+2Fe3+═3Fe2+
.(5)溶液趁热过滤的原因是
减小FeSO4的损失
减小FeSO4的损失
.塞紧试管口的目的是防止空气进入试管将Fe2+氧化为Fe3+
防止空气进入试管将Fe2+氧化为Fe3+
.(6)静置冷却一段时间后,在试管中观察到的现象是
有浅绿色晶体析出
有浅绿色晶体析出
.