摘要:21.已知反应 ①过氧化钠与水反应 ②氧化钠与水反应 ③钠与水反应 ④2F2 + 2H2O = 4HF + O2 根据上述反应.试填序号回答: (1) 上述反应中不属于氧化还原反应的有 . (2) 水被氧化的有 . (3) 水被还原的有 . (4) 是氧化还原反应,但水既不被氧化.又不被还原的是 .
网址:http://m.1010jiajiao.com/timu3_id_169158[举报]
 已知氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用.为了探究二氧化硫的漂白作用到底是二氧化硫本身还是二氧化硫与水作用的产物,某学习小组设计了如图装置来进行实验.请回答相关问题.
已知氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用.为了探究二氧化硫的漂白作用到底是二氧化硫本身还是二氧化硫与水作用的产物,某学习小组设计了如图装置来进行实验.请回答相关问题.亚硫酸钠浓硫酸品红的酒精溶液
(1)为了探究干燥的SO2能不能使品红褪色,某同学设计了如图所示实验装置,请指出实验装置图设计中的不合理之处.①
二氧化硫没有干燥(或缺少二氧化硫的干燥装置);
二氧化硫没有干燥(或缺少二氧化硫的干燥装置);
;②没有尾气吸收装置
没有尾气吸收装置
.(2)按照修改后的装置,实验中控制二氧化硫以大约每秒3个气泡的速度通过品红的酒精溶液时,经过一小时后,品红仍不褪色.这说明品红褪色的原因不是二氧化硫直接导致.为此,SO2能使品红的水溶液褪色的可能微粒有
H2SO3、HSO3-、SO3 2-
H2SO3、HSO3-、SO3 2-
.(3)甲同学实验如下:取等量、相同浓度的品红水溶液于两支试管中,再分别加入少量亚硫酸钠固体和亚硫酸氢钠固体,两支试管中的品红都褪色,对此,他得出结论:使品红褪色的微粒是HSO3-和SO32-,不是H2SO3.你认为他的结论是否正确
不正确,
不正确,
,其理由是因亚硫酸根离子和亚硫酸氢根离子都会水解生成亚硫酸
因亚硫酸根离子和亚硫酸氢根离子都会水解生成亚硫酸
.(4)为了进一步探究,乙组同学做了如下实验:分别取相同浓度的品红水溶液各20ml于两只小烧杯中,两只烧杯中同时一次性各加入20ml 0.1mol/L的亚硫酸钠,20ml1mol/L的亚硫酸氢钠溶液,发现加入亚硫酸钠溶液的品红褪色较快.
①微粒浓度与褪色快慢关系,请用“多”或“少”填写“
①
①
”内容.| 同浓度溶液 | SO32- | HSO3- | H2SO3 | 褪色速度 |
| Na2SO3溶液 | 多 | 少 | 少 | 快 |
| NaHSO3溶液 | 较上面 少 少 |
较上面 多 多 |
较上面 多 多 |
慢 |
使品红褪色的微粒是亚硫酸根离子
使品红褪色的微粒是亚硫酸根离子
.已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH?CH3COO-+H+△H>0.
(1)常温常压下,在 pH=5的稀醋酸溶液中,c(CH3COO-)=
a.加入少量0.10mol?L-1的稀盐酸 b.加热CH3COOH溶液
c.加水稀释至0.010mol?L-1 d.加入少量冰醋酸
e.加入少量氯化钠固体 f.加入少量0.10mol?L-1的NaOH溶液
(2)将等质量的锌投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V盐酸
(3)常温下,向体积为Va mL,pH为3的醋酸溶液中滴加pH=11的NaOH溶液Vb mL至溶液恰好呈中性,则Va与Vb的关系是:
查看习题详情和答案>>
(1)常温常压下,在 pH=5的稀醋酸溶液中,c(CH3COO-)=
10-5mol/L
10-5mol/L
;下列方法中,可以使0.10mol?L-1 CH3COOH的电离程度增大的是bcf
bcf
?a.加入少量0.10mol?L-1的稀盐酸 b.加热CH3COOH溶液
c.加水稀释至0.010mol?L-1 d.加入少量冰醋酸
e.加入少量氯化钠固体 f.加入少量0.10mol?L-1的NaOH溶液
(2)将等质量的锌投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V盐酸
<
<
V醋酸,反应的最初速率为:υ盐酸=
=
υ醋酸.(3)常温下,向体积为Va mL,pH为3的醋酸溶液中滴加pH=11的NaOH溶液Vb mL至溶液恰好呈中性,则Va与Vb的关系是:
Vb>Va
Vb>Va
;溶液中各离子的浓度按照由大到小排序为c(Na+)=c(CH3COO-)>c(H+)=c(OH-)
c(Na+)=c(CH3COO-)>c(H+)=c(OH-)
.已知:90℃时,水的离子积常数为Kw=38×10-14,在此温度下,将pH=3的盐酸和pH=11的氢氧化钠溶液等体积混合,则混合溶液中的c(H+)=2.05×10-11mol/L
2.05×10-11mol/L
(保留三位有效数字).已知NH4+离子与HCHO在水溶液中发生如下反应:4NH4++6HCHO→(CH2)6N4+4H++6H2O,现有一瓶失去标签的铵盐,已知其中氮元素只存在在NH4+中,为测其氮的含量,现称取2.62g样品,溶于水后加入足量甲醛配成100mL溶液,从中取出10.00mL,加适量水后滴入数滴酚酞试液,再用0.100mol/L的NaOH溶液滴定,装有氢氧化钠溶液的滴定管初读数为0.20mL,当滴到溶液出现粉红色,且在半分钟内不褪去时,末读数为19.40mL.
试计算:
(1)滴定过程中消耗氢氧化钠溶液 mL.
(2)与样品发生反应的甲醛的物质的量为 mol.
(3)该铵盐中氮的质量分数.(计算过程和结果请保留3位有效数字)
查看习题详情和答案>>
试计算:
(1)滴定过程中消耗氢氧化钠溶液
(2)与样品发生反应的甲醛的物质的量为
(3)该铵盐中氮的质量分数.(计算过程和结果请保留3位有效数字)
已知:H2A的A2-可表示S2-、S
、S
、Si
或C
离子.
(1)常温下,向20mL 0.2mol?L-1 H2A溶液中滴加0.2mol?L-1 NaOH溶液.有关微粒物质的量变化如下图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-).请根据图示填空:
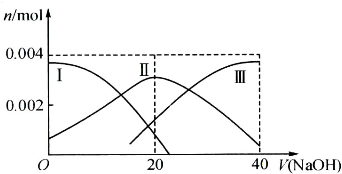
①当V(NaOH)=20mL时,溶液中离子浓度大小关系: ;
②等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水 (填“大”、“小”或“相等”),欲使NaHA溶液呈中性,可以向其中加入 .
(2)有关H2A的钠盐的热化学方程式如下:
①Na2SO4(s)═Na2S(s)+2O2(g)△H1=+1011.0kJ?mol-1;
②2C(s)+O2(g)═2CO(g)△H2=-221.0kJ?mol-1.
则Na2SO4(s)+4C(s)═Na2S(s)+4CO(g)△H3= kJ?mol-1;
工业上制备Na2S时往往要加入过量的碳,同时还要通入空气,目的有两个,其一是利用碳与氧气反应放出的热维持反应所需温度,其二是 .
(3)若H2A为硫酸:t℃时,有pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,则该温度下水的离子积常数KW= .
查看习题详情和答案>>
| O | 2- 4 |
| O | 2- 3 |
| O | 2- 3 |
| O | 2- 3 |
(1)常温下,向20mL 0.2mol?L-1 H2A溶液中滴加0.2mol?L-1 NaOH溶液.有关微粒物质的量变化如下图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-).请根据图示填空:

①当V(NaOH)=20mL时,溶液中离子浓度大小关系:
②等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水
(2)有关H2A的钠盐的热化学方程式如下:
①Na2SO4(s)═Na2S(s)+2O2(g)△H1=+1011.0kJ?mol-1;
②2C(s)+O2(g)═2CO(g)△H2=-221.0kJ?mol-1.
则Na2SO4(s)+4C(s)═Na2S(s)+4CO(g)△H3=
工业上制备Na2S时往往要加入过量的碳,同时还要通入空气,目的有两个,其一是利用碳与氧气反应放出的热维持反应所需温度,其二是
(3)若H2A为硫酸:t℃时,有pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,则该温度下水的离子积常数KW=