摘要:已知:Fe2O3+2CO 2Fe+3CO2 (1) 标出该反应中电子转移的方向和数目 (2) 指出该反应中.氧化剂是 .还原剂是 , (3) 在该反应中.若有2mol e-发生转移.要标准状况下.可生成CO2的体积为 .
网址:http://m.1010jiajiao.com/timu3_id_169102[举报]
能源的开发、利用与人类社会的可持续发展息息相关,怎样充分利用好能源是摆在人类面前的重大课题.
I.已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H=akJ?mol-1
CO(g)+1/2O2(g)=CO2(g)△H=bkJ?mol-1
C(石墨)+O2(g)=CO2(g)△H=ckJ?mol-1
则反应:4Fe(s)+3O2(g)=2Fe2O3(s)的焓变△H=
Ⅱ.(1)依据原电池的构成原理,下列化学反应在理论上可以设计成原电池的是
A.C(s)+CO2(g)=2CO(g)
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)
C.2H2O(l)=2H2(g)+O2(g)
D.CH4(g)+2O2(g)=CO2(g)+2H2O(l)
若以KOH溶液为电解质溶液,依据所选反应可以设计成一个原电池,请写出该原电池的电极反应.
负极:
正极:
(2)二氧化氯(ClO2)是一种高效安全的自来水消毒剂.ClO2是一种黄绿色气体,易溶于水.实验室以NH4Cl、盐酸、NaClO2为原料制备ClO2流程如下:

已知:电解过程中发生的反应为:
NH4Cl+2HCl
NCl3+3H2↑;假设NCl3中氮元素为+3价.
①写出电解时阴极的电极反应式
②在阳极上放电的物质(或离子)是
③除去ClO2中的NH3可选用的试剂是
A.生石灰 B.碱石灰 C.浓H2SO4 D.水
④在生产过程中,每生成1mol ClO2,需消耗
mol NCl3.
查看习题详情和答案>>
I.已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H=akJ?mol-1
CO(g)+1/2O2(g)=CO2(g)△H=bkJ?mol-1
C(石墨)+O2(g)=CO2(g)△H=ckJ?mol-1
则反应:4Fe(s)+3O2(g)=2Fe2O3(s)的焓变△H=
6(c-b)-2a
6(c-b)-2a
kJ?mol-1.Ⅱ.(1)依据原电池的构成原理,下列化学反应在理论上可以设计成原电池的是
D
D
(填序号).A.C(s)+CO2(g)=2CO(g)
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)
C.2H2O(l)=2H2(g)+O2(g)
D.CH4(g)+2O2(g)=CO2(g)+2H2O(l)
若以KOH溶液为电解质溶液,依据所选反应可以设计成一个原电池,请写出该原电池的电极反应.
负极:
CH4-8e-+10OH-=CO32-+7H2O
CH4-8e-+10OH-=CO32-+7H2O
,正极:
O2+2H2O+4e-=4OH-
O2+2H2O+4e-=4OH-
.(2)二氧化氯(ClO2)是一种高效安全的自来水消毒剂.ClO2是一种黄绿色气体,易溶于水.实验室以NH4Cl、盐酸、NaClO2为原料制备ClO2流程如下:

已知:电解过程中发生的反应为:
NH4Cl+2HCl
| ||
. |
①写出电解时阴极的电极反应式
2H++2e-=H2↑
2H++2e-=H2↑
.②在阳极上放电的物质(或离子)是
NH4Cl(NH4+)
NH4Cl(NH4+)
.③除去ClO2中的NH3可选用的试剂是
C
C
(填序号)A.生石灰 B.碱石灰 C.浓H2SO4 D.水
④在生产过程中,每生成1mol ClO2,需消耗
| 1 |
| 6 |
| 1 |
| 6 |
 I.高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
I.高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H
(1)已知:①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1
②C(石墨)+CO2(g)=2CO(g)△H2,则△H=
(2)高炉炼铁反应的平衡常数表达式K=
(3)在T℃时,该反应的平衡常数K=64,在 2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡.
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 1.5 | 1.0 | 1.0 |
②下列说法正确的是
A.若容器压强恒定,反应达到平衡状态 B.若容器内气体密度恒定,反应达到平衡状态
C.甲容器中CO的平衡转化率大于乙的 D.增加Fe2O3就能提高CO的转化率
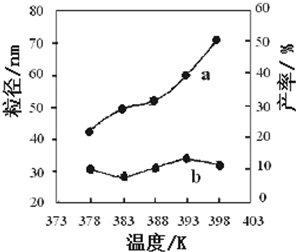
II.纳米MgO可用尿素与氯化镁合成.某小组研究该反应在温度为378~398K时的反应
时间、反应物配比等因素对其产率的影响.请完成以下实验设计表:
| 编号 | 温度/K | 反应时间/h | 反应物物质的量配比 | 实验目的 |
| ① | 378 | 3 | 3:1 | 实验②和④探究 实验②和 |
| ② | 378 | 4 | 4:1 | |
| ③ | 378 | 3 | ||
| ④ | 398 | 4 | 4:1 |
高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=akJmol-1
(1)已知:①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJmol-1
②C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJmol-1
则a=
(2)冶炼铁反应的平衡常数表达式K=
,温度升高后,K值
(3)在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡.
①甲容器中CO的平衡转化率为
②下列说法正确的是
a.若容器内气体密度恒定时,标志反应达到平衡状态
b.甲容器中CO的平衡转化率大于乙的
c.甲、乙容器中,CO的平衡浓度之比为2:3
d.增加Fe2O3可以提高CO的转化率
(4)采取一定措施可防止钢铁腐蚀.下列装置中的烧杯里均盛有等浓度、等体积的NaCl溶液.
①在a~c装置中,能保护铁的是
②若用d装置保护铁,X极的电极材料应是
查看习题详情和答案>>
Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=akJmol-1
(1)已知:①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJmol-1
②C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJmol-1
则a=
-28.5
-28.5
kJ mol-1.(2)冶炼铁反应的平衡常数表达式K=
| c3(CO2) |
| c3(CO) |
| c3(CO2) |
| c3(CO) |
减小
减小
(填“增大”、“不变”或“减小”)(3)在T℃时,该反应的平衡常数K=64,在2L恒容密闭容器甲和乙中,分别按下表所示加入物质,反应经过一段时间后达到平衡.
| Fe2O3 | CO | Fe | CO2 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
60%
60%
.②下列说法正确的是
ac
ac
(填字母).a.若容器内气体密度恒定时,标志反应达到平衡状态
b.甲容器中CO的平衡转化率大于乙的
c.甲、乙容器中,CO的平衡浓度之比为2:3
d.增加Fe2O3可以提高CO的转化率
(4)采取一定措施可防止钢铁腐蚀.下列装置中的烧杯里均盛有等浓度、等体积的NaCl溶液.
①在a~c装置中,能保护铁的是
bc
bc
(填字母).②若用d装置保护铁,X极的电极材料应是
锌
锌
(填名称).
(2012?唐山二模)高炉炼铁是冶炼铁的主要方法,发生的主要反应为:
Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=akJ?mol-1
(1)已知:
①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489kJ?mol-1
②C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJ?mol-1
则a=
(2)在T℃时,该反应的平衡常数K=64,在体积均为2L的恒容密闭容器甲和乙中,分别按下所示加入物质,反应经过一段时间后达到平衡.
①甲容器中CO的平衡转化率为
②下列说法正确的是
a.增加Fe2O3的量可以提高CO的转化率
b.甲、乙容器中CO的平衡转化率之比大于1
c.甲、乙容器中,CO的平衡浓度之比为2:3
d.若容器内气体密度恒定时,标志反应达到平衡状态
(3)实验室有提纯后的铁矿粉(含氧化铁、氧化亚铁中的一种或两种),请设计实验探究其成分:
实验室仅提供如下仪器和试剂:烧杯、试管、玻璃棒、药匙、胶头滴管、酒精灯、试管夹;3mol/L H2SO4溶液、0.01mol/L KMnO4溶液、20% KSCN溶液、蒸馏水.
①提出合理假设:
假设1:只含氧化亚铁;
假设2:只含氧化铁;
假设3:
②请在下列表格中填写实验步骤、预期现象与结论.(可不必填满)
查看习题详情和答案>>
Fe2O3(s)+3CO(g)?2Fe(s)+3CO2(g)△H=akJ?mol-1
(1)已知:
①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489kJ?mol-1
②C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJ?mol-1
则a=
-28.5
-28.5
kJ?mol-1,炼铁反应平衡常数K随温度升高而减小
减小
(填“增大”、“不变”或“减小”).(2)在T℃时,该反应的平衡常数K=64,在体积均为2L的恒容密闭容器甲和乙中,分别按下所示加入物质,反应经过一段时间后达到平衡.
| Fe2O3 | CO | Fe | CO2 | |
| 甲 | 1.0mol | 1.0mol | 1.0mol | 1.0mol |
| 乙 | 1.0mol | 2.0mol | 1.0mol | 1.0mol |
60%
60%
.②下列说法正确的是
cd
cd
(填字母).a.增加Fe2O3的量可以提高CO的转化率
b.甲、乙容器中CO的平衡转化率之比大于1
c.甲、乙容器中,CO的平衡浓度之比为2:3
d.若容器内气体密度恒定时,标志反应达到平衡状态
(3)实验室有提纯后的铁矿粉(含氧化铁、氧化亚铁中的一种或两种),请设计实验探究其成分:
实验室仅提供如下仪器和试剂:烧杯、试管、玻璃棒、药匙、胶头滴管、酒精灯、试管夹;3mol/L H2SO4溶液、0.01mol/L KMnO4溶液、20% KSCN溶液、蒸馏水.
①提出合理假设:
假设1:只含氧化亚铁;
假设2:只含氧化铁;
假设3:
既含氧化亚铁又含氧化铁
既含氧化亚铁又含氧化铁
.②请在下列表格中填写实验步骤、预期现象与结论.(可不必填满)
| 实验操作 | 预期现象及结论 |
| 步骤1:取少量样品于烧杯中加适量稀硫酸溶解 | \ |
| 步骤2: 取少量步骤1所得溶液于试管中滴加几滴KSCN溶液 取少量步骤1所得溶液于试管中滴加几滴KSCN溶液 |
若溶液变红则证明样品中含氧化铁 若不变红则证明样品中不含氧化铁 若溶液变红则证明样品中含氧化铁 若不变红则证明样品中不含氧化铁 |
| 步骤3: 另取少量步骤1所得溶液于试管中滴加几滴KMnO4溶液 另取少量步骤1所得溶液于试管中滴加几滴KMnO4溶液 |
若KMnO4溶液紫色褪去则证明样品中含氧化亚铁 若KMnO4溶液不褪色则证明样品中不含氧化亚铁 若KMnO4溶液紫色褪去则证明样品中含氧化亚铁 若KMnO4溶液不褪色则证明样品中不含氧化亚铁 |
| 步骤4: 空 空 |
空 空 |
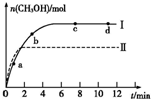 研究CO2的利用对促进低碳社会的构建具有重要的意义.
研究CO2的利用对促进低碳社会的构建具有重要的意义.(1)某实验将CO2和H2充入一定体积的密闭容器中,在两种不同条件(Ⅰ、Ⅱ)下,发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol,测得CH3OH的物质的量随时间变化如图所示,回答下列问题:
①图中a点正反应速率
②若容器容积不变,只改变下列某一措施可增大CO2转化率的是
A.降低温度
B.使用合适的催化剂
C.将CH3OH从体系中分离
D.充入氦气,使体系总压强增大
③曲线Ⅰ、Ⅱ的平衡常数大小关系为KⅠ
(2)将CO2与焦炭作用生成CO,CO可用于炼铁等.
①已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJ?mol-1
C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJ?mol-1
则一氧化碳还原氧化铁的热化学方程式为
②若利用CO燃烧反应设计成燃料电池(以KOH溶液为介质),则该电池的负极反应式为