题目内容
 研究CO2的利用对促进低碳社会的构建具有重要的意义.
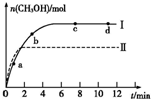
研究CO2的利用对促进低碳社会的构建具有重要的意义.(1)某实验将CO2和H2充入一定体积的密闭容器中,在两种不同条件(Ⅰ、Ⅱ)下,发生反应CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol,测得CH3OH的物质的量随时间变化如图所示,回答下列问题:
①图中a点正反应速率
②若容器容积不变,只改变下列某一措施可增大CO2转化率的是
A.降低温度
B.使用合适的催化剂
C.将CH3OH从体系中分离
D.充入氦气,使体系总压强增大
③曲线Ⅰ、Ⅱ的平衡常数大小关系为KⅠ
(2)将CO2与焦炭作用生成CO,CO可用于炼铁等.
①已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJ?mol-1
C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJ?mol-1
则一氧化碳还原氧化铁的热化学方程式为
②若利用CO燃烧反应设计成燃料电池(以KOH溶液为介质),则该电池的负极反应式为
②容器容积不变,只改变下列某一措施可增大CO2转化率,平衡正向进行,依据化学反应是气体体积减小的放热反应分析;
A.降低温度,平衡正向进行,二氧化碳转化率增大;
B.使用合适的催化剂,改变化学反应速率不能改变化学平衡;
C.将CH3OH从体系中分离,平衡正向进行;
D.充入氦气,使体系总压强增大,纷纷呀不变,平衡不动;
③图象分析Ⅰ平衡时甲醇物质的量比Ⅱ平衡时甲醇物质的量大,Ⅱ达到平衡所需要的时间短,温度高,平衡逆向进行,说明平衡常数减小;
(2)①依据热化学方程式和盖斯定律计算得到所需热化学方程式;
②燃料电池中,燃料在原电池中的负极失电子发生氧化反应,碱溶液中生成碳酸盐.
②A.降低温度,平衡正向进行,二氧化碳转化率增大,故A正确;
B.使用合适的催化剂,改变化学反应速率不能改变化学平衡,转化率不变,故B错误;
C.将CH3OH从体系中分离,平衡正向进行,二氧化碳转化率增大,故C正确;
D.充入氦气,使体系总压强增大,纷纷呀不变,平衡不动,故D错误;
故答案为:AC;
③图象分析Ⅰ平衡时甲醇物质的量比Ⅱ平衡时甲醇物质的量大,Ⅱ达到平衡所需要的时间短,温度高,平衡逆向进行,说明平衡常数减小,KⅠ>KⅡ,
故答案为:大于;
(2)①a、Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJ?mol-1
b、C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJ?mol-1
依据盖斯定律a-b×3得到Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5 kJ?mol-1;
故答案为:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5 kJ?mol-1;
②利用CO燃烧反应设计成燃料电池(以KOH溶液为介质),燃料电池中,燃料在原电池中 的负极失电子发生氧化反应,碱溶液中生成碳酸盐,则该电池的负极反应式为:CO+4OH--2e-=CO32-+2H2O,
故答案为:CO+4OH--2e-=CO32-+2H2O.

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案(14分)研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)已知石墨的标准燃烧热为y kJ·mol-1,1.2g石墨在1.68L(标准状况)氧气中燃烧,至反应物耗尽,放出x kJ热量。则石墨与氧气反应生成CO的热化学方程式为 ,
(2)高温时,用CO还原MgSO4可制备高纯MgO。
①750℃时,测得气体中含等物质的量SO2和SO3,此时反应的化学方程式是 。
②由MgO可制成“镁—次氯酸盐”燃料电池,其装置示意图如图1,该电池反应的离子方程式为 。



图1 图2 图3
(3)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:
CO2(g) +3H2(g)  CH3OH(g) +H2O(g) △H
CH3OH(g) +H2O(g) △H
①该反应的平衡常数表达式为K= 。
②取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图2所示,则上述CO2转化为甲醇反应的ΔH (填“>” “<”或“=”)0。
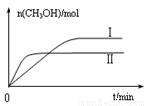
③在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图3所示,曲线I、Ⅱ对应的平衡常数大小关系为KⅠ KⅡ(填“>” “<”或“=”)。
④一定温度下,在容积相同且固定的两个密闭容器中,按如下方式投入反应物,一段时间后达到平衡。
|
容 器 |
甲 |
乙 |
|
反应物 投入量 |
1molCO2 3molH2 |
a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
若甲中平衡后气体的压强为开始时的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持反应逆向进行,则c的取值范围为 。

 研究CO2的利用对促进低碳社会的构建具有重要的意义.
研究CO2的利用对促进低碳社会的构建具有重要的意义. CH3OH(g)+H2O(g)
△H
CH3OH(g)+H2O(g)
△H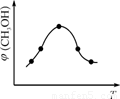
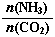 =3,达平衡时CO2的转化率为60%,则NH3的平衡转化率为
=3,达平衡时CO2的转化率为60%,则NH3的平衡转化率为