摘要:(1)①SiO2,②Si.(2)①3SiCl4+4NH3=Si3N4+12HCl,②Si3N4+6MgO=3SiO2+2Mg3N2, ③抗氧化.耐磨损.抗腐蚀.润滑性.抗冷热冲击等.
网址:http://m.1010jiajiao.com/timu3_id_167721[举报]
 (2010?崇文区二模)X、Y、Z、W均为含有10电子的微粒,其中X、Y、Z为分子,W为离子,且X与Z分子中含有的共用电子对数之比为3:4.
(2010?崇文区二模)X、Y、Z、W均为含有10电子的微粒,其中X、Y、Z为分子,W为离子,且X与Z分子中含有的共用电子对数之比为3:4.请回答:
(1)X的电子式


Ca(OH)2+2NH4Cl
CaCl2+2NH3↑+2H2O;
| ||
Ca(OH)2+2NH4Cl
CaCl2+2NH3↑+2H2O;
.
| ||
(2)已知:W+X+H2O一白色沉淀,为进一步确定W,进行如下实验,请补全实验操作、现象和结论:取上述白色沉淀少量置于试管中,
加入足量的氢氧化钠溶液,若观察到白色沉淀溶解,则证明W为Al3+;若观察到白色沉淀不溶解,则证明W为Mg2+
加入足量的氢氧化钠溶液,若观察到白色沉淀溶解,则证明W为Al3+;若观察到白色沉淀不溶解,则证明W为Mg2+
.(3)常温下,取10mL pH=a的Y的稀溶液,加水稀释时pH随溶液体积的变化如图所示,则Y的化学式为
HF
HF
,下列叙述正确的是a、b
a、b
(选填字母).
a.Y的水溶液可用作刻蚀玻璃
b.相同温度时与相同浓度的盐酸比较,Y的水溶液的导电能力弱
c.稀释后,阴离子的物质的量浓度之和增大
(4)分子Z中所含元素对应的单质A及A与B形成的化合物可进行如下转化:

当n=1时,请写出A-ABn的化学方程式
C+H2
CO+H2(或2C+SiO2
Si+2CO)
| ||
| ||
C+H2
CO+H2(或2C+SiO2
Si+2CO)
(写出一个即可).
| ||
| ||
(2009?金华模拟)马格尼特法冶炼镁的工艺流程如图.炉料中除有煅烧白云石和硅铁外,还加入煅烧过的铝土矿,加Al2O3的主要目的是降低渣的熔点,便于液态排渣.已知白云石的成分为CaCO3?MgCO3,硅铁是指含有55%硅左右的合金,作还原剂,最后得到低品位的硅铁含硅量少的合金,简易流程图如下:
试回答下列问题
(1)反应①白云石煅烧得CaO?MgO的化学方程式为:
(2)反应②还原炉中发生反应生成镁和炉渣的化学方程式为:
(3)沪渣是一种工业生产的重要原料,可作为生产
(4)马格尼特法冶炼镁,一台4500千瓦的炉子可日产约7.2吨镁,一天至少约消耗含硅60%的硅铁
查看习题详情和答案>>

试回答下列问题
(1)反应①白云石煅烧得CaO?MgO的化学方程式为:
CaCO3?MgCO3
CaO?MgO+2CO2↑
| ||
CaCO3?MgCO3
CaO?MgO+2CO2↑
| ||
(2)反应②还原炉中发生反应生成镁和炉渣的化学方程式为:
2(CaO?MgO)+Si+0.3Al2O3
2Mg+2CaO?SiO2?0.3Al2O3
| ||
2(CaO?MgO)+Si+0.3Al2O3
2Mg+2CaO?SiO2?0.3Al2O3
| ||
(3)沪渣是一种工业生产的重要原料,可作为生产
水泥
水泥
的原料.(4)马格尼特法冶炼镁,一台4500千瓦的炉子可日产约7.2吨镁,一天至少约消耗含硅60%的硅铁
7.0
7.0
吨(假设硅全部反应)如图1是元素周期表的另一种画法--三角形元素周期表的一部分,图上标有第ⅦA族和碳、钾两种元素的位置.回答下列问题:
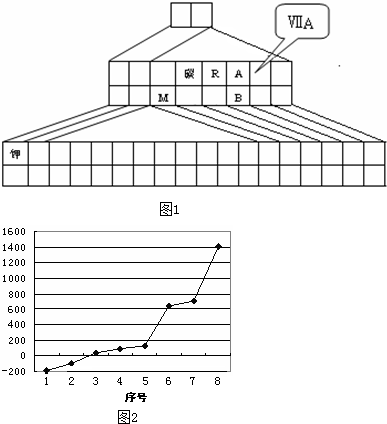
(1)在图1中将过渡元素所在的位置“涂黑”.
(2)R的第一电离能 A的第一电离能(填大于、小于或等于);写出铷元素原子的外围电子排布式 ;
(3)R的氢化物在A的氢化物中溶解度极大,原因是 ;A的氢化物比B的氢化物热稳定性强,原因是 .
(4)图中A、B两元素形成的离子B2
中,B元素呈现最高价,B原子位于由A原子组成的四面体的中心,且所有原子的最外层电子均满足8电子结构.该离子可能具有的化学性质是 ,依据是 .
(5)第三周期8种元素按单质熔点(℃)高低的顺序如图2,(已知序号“1”代表Ar),其中序号“8”代表 (填元素符号);其中电负性最大的是 (填下图中的序号).
(6)C、Si为同一主族的元素,CO2和SiO2化学式相似,但结构和性质有很大不同.CO2中C与O原子间形成σ键和π键,SiO2中Si与O原子间不形成上述π键.从原子半径大小的角度分析,为何C、O原子间能形成,而Si、O原子间不能形成上述π键的原因 .
查看习题详情和答案>>

(1)在图1中将过渡元素所在的位置“涂黑”.
(2)R的第一电离能
(3)R的氢化物在A的氢化物中溶解度极大,原因是
(4)图中A、B两元素形成的离子B2
| A | 2- 8 |
(5)第三周期8种元素按单质熔点(℃)高低的顺序如图2,(已知序号“1”代表Ar),其中序号“8”代表
(6)C、Si为同一主族的元素,CO2和SiO2化学式相似,但结构和性质有很大不同.CO2中C与O原子间形成σ键和π键,SiO2中Si与O原子间不形成上述π键.从原子半径大小的角度分析,为何C、O原子间能形成,而Si、O原子间不能形成上述π键的原因
镁是一种很活泼的金属,常用作脱硫剂、脱氧剂.现在,某化学兴趣小组对金属镁的性质进行实验探究.他们首先在网络上查找到了一些关于金属镁的性质的方程式如下:
①2Mg+O2
2MgO;②3Mg+N2
Mg3N2;③2Mg+CO2
2MgO+C
④Mg+H2O
MgO+H2↑;⑤Mg3N2+6H2O
3Mg(OH)2+2NH3↑
完成下列填空:
现拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2).实验装置如下(部分夹持仪器省略).
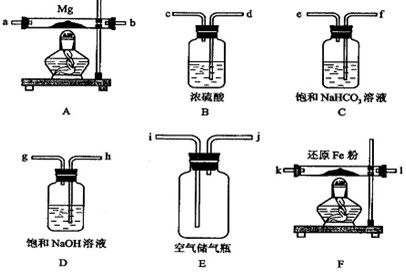
(1)装置F的作用是 .通气后,如果同时点燃A、F装置的酒精灯,对实验结果的影响是 ,产生这一现象的原因是 .
(2)请设计一个实验,验证产物是氮化镁: .
镁在电子工业中利用镁制取硅的反应为:2Mg+SiO2
2MgO+Si?同时有副反应发生:2Mg+Si
Mg2Si?
Mg2Si遇盐酸迅速反应生成SiH4(硅烷).SiH4在常温下是一种不稳定、易分解的气体.
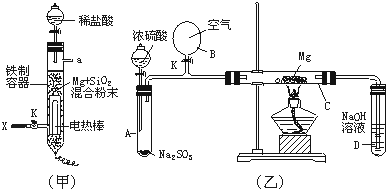
(3)图(甲)是进行Mg与SiO2反应的实验装置.由于O2的存在对该实验有较大影响,实验中应通入X气体作为保护气.X气体应选用①CO2、②N2、③H2中的 (选填编号).实验开始时,必须先通入X的气体,再接通电源加热反应物,其理由是 ;当反应引发后,切断电源,反应能继续进行,其原因是 .
(4)图(乙)所示装置进行的实验如下:先关闭K,使A中反应进行;加热玻璃管C,可观察到C管中发出耀眼白光,产生白烟,管壁上附着有淡黄色物质.实验完成后,将C管中固体全部加入盐酸中,有臭鸡蛋气味的气体生成.C中的Mg应放在不锈钢垫片上而不能直接接触管壁,这是因为 .停止实验时,先打开K,再停止滴加浓硫酸并熄灭酒精灯.橡胶气胆B在实验中的作用是 .C中全部反应产物有 (填化学式).
 查看习题详情和答案>>
查看习题详情和答案>>
①2Mg+O2
| 点燃 |
| 点燃 |
| 点燃 |
④Mg+H2O
| 点燃 |
| 点燃 |
完成下列填空:
现拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2).实验装置如下(部分夹持仪器省略).

(1)装置F的作用是
(2)请设计一个实验,验证产物是氮化镁:
镁在电子工业中利用镁制取硅的反应为:2Mg+SiO2
| △ |
| △ |
Mg2Si遇盐酸迅速反应生成SiH4(硅烷).SiH4在常温下是一种不稳定、易分解的气体.
(3)图(甲)是进行Mg与SiO2反应的实验装置.由于O2的存在对该实验有较大影响,实验中应通入X气体作为保护气.X气体应选用①CO2、②N2、③H2中的
(4)图(乙)所示装置进行的实验如下:先关闭K,使A中反应进行;加热玻璃管C,可观察到C管中发出耀眼白光,产生白烟,管壁上附着有淡黄色物质.实验完成后,将C管中固体全部加入盐酸中,有臭鸡蛋气味的气体生成.C中的Mg应放在不锈钢垫片上而不能直接接触管壁,这是因为
 查看习题详情和答案>>
查看习题详情和答案>>
(附加题)X、Y、Z为常见的三种单质,Z是绿色植物光合作用的产物之一,A、B为常见化合物.它们在一定条件下可发生如图所示的反应(均是在非溶液中进行的反应):

(1)当X为金属,Y为非金属时,A是
(2)当X为非金属,Y为金属时,X可能是
(3)当X与Y均为金属时,X与A反应的化学方程式是
(4)当X与Y均为非金属时,若X与Y同主族,X与A反应的化学方程式是
查看习题详情和答案>>

(1)当X为金属,Y为非金属时,A是
镁
镁
(填名称).(2)当X为非金属,Y为金属时,X可能是
H2
H2
或C
C
(均填化学式).(3)当X与Y均为金属时,X与A反应的化学方程式是
8Al+3Fe3O4
9Fe+4Al2O3(或2Al+Fe2O3
2Fe+Al2O3)
| ||
| ||
8Al+3Fe3O4
9Fe+4Al2O3(或2Al+Fe2O3
2Fe+Al2O3)
.
| ||
| ||
(4)当X与Y均为非金属时,若X与Y同主族,X与A反应的化学方程式是
2C+SiO2
Si+2CO↑
| ||
2C+SiO2
Si+2CO↑
.若X与Y不在同一主族,X与A反应的化学方程式是
| ||
C+H2O
H2+CO
| ||
C+H2O
H2+CO
.
| ||