摘要:26.在反应2KMnO4+16HCl==2KCl+2MnCl2+5Cl2↑+8H2O中. (1)试问该反应中转移电子总数是多少e-?被氧化和未被氧化的HCl的质量之比是多少? (2)若有7.3gHCl被氧化.产生Cl2的质量是多少g?
网址:http://m.1010jiajiao.com/timu3_id_166814[举报]
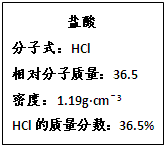
如图为实验室某浓盐酸试剂瓶的标签上的有关数据,试回答下列问题:

(1)该浓盐酸中HCl的物质的量浓度为___________。若用KMnO4。氧化上述HCl。其反应方程式如下:
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
(2)1molKMnO4完全反应,反应后溶液的体积为2L,则所得产物中Cl-的物质的量浓度为____________。
(3)8molHCI完全反应,产生的Cl2在标准状况下的体积为_____________。
查看习题详情和答案>>