题目内容
如图为实验室某浓盐酸试剂瓶的标签上的有关数据,试回答下列问题:
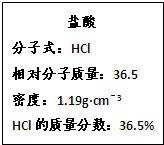
(1)该浓盐酸中HCl的物质的量浓度为___________。若用KMnO4。氧化上述HCl。其反应方程式如下:
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
(2)1molKMnO4完全反应,反应后溶液的体积为2L,则所得产物中Cl-的物质的量浓度为____________。
(3)8molHCI完全反应,产生的Cl2在标准状况下的体积为_____________。

(1)该浓盐酸中HCl的物质的量浓度为___________。若用KMnO4。氧化上述HCl。其反应方程式如下:
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
(2)1molKMnO4完全反应,反应后溶液的体积为2L,则所得产物中Cl-的物质的量浓度为____________。
(3)8molHCI完全反应,产生的Cl2在标准状况下的体积为_____________。
(8分)(1)11.9 mol/L(2分) (2)1.5mol/L (3分) (3)56L(3分)
试题分析:(1)根据c=
 可知,该盐酸的浓度c=
可知,该盐酸的浓度c=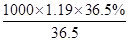 mol/L=11.9mol/L.
mol/L=11.9mol/L.(2)1mol KMnO4恰好和盐酸全部完全反应,则:
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
2mol 2mol 2mol 5mol
1mol 1mol 1mol 2.5mol
则反应后溶液中Cl-的浓度=(1mol+1mol×2)÷2L=1.5mol/L
(3)生成氢气在标准状况下的体积为2.5mol×22.4L/mol=56L

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目