摘要:读识字4.看图说一说图上画了什么?
网址:http://m.1010jiajiao.com/timu3_id_166063[举报]
某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用如图所示装置先进行了有关实验:
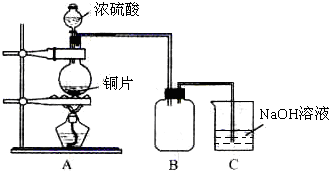
(1)B是用来收集实验中产生的气体的装置,但未将导管画全,请在图上把导管补充完整.
(2)实验中他们取6.4g 铜片和12mL 18mol?L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余.
①写出铜跟浓硫酸反应的化学方程式: ;
②有一定量的余酸但未能使铜片完全溶解,你认为其中原因是 ;
(3)为定量测定余酸的物质的量浓度,该小组学生进行了如下设计:
先测定铜与浓硫酸反应产生的SO2的量,再计算余酸的物质的量浓度.他们认为测定二氧化硫的量的方法有多种,你认为下列实验方案中可行的是 (填写编号).
A.将装置A产生的气体缓缓通过预先称量过的盛有碱石灰的干燥管,结束反应后再次称量
B.将装置A产生的气体缓缓通入足量用稀硫酸酸化的高锰酸钾溶液,再加入足量氯化钡溶液,过滤、洗涤、干燥、称量沉淀
C.用排水法测定装置A产生气体的体积(已折算成标准状况)
D.将装置A产生的气体缓缓通入足量氢氧化钡溶液,反应完全后,过滤、洗涤、干燥、称量沉淀
E.将装置A产生的气体缓缓通入足量硝酸酸化的硝酸钡溶液,反应完全后,过滤、洗涤、干燥、称量沉淀
请你对不可行的方案中选出一例进行分析: [要求标明不可行的方案序号、说出不可行的理由及造成的误差(偏高或偏低)].
(4)请你再设计一种其他可行的实验方案,来测定余酸的物质的量浓度,简要写出操作步骤及需要测定的数据(不必计算) .
查看习题详情和答案>>

(1)B是用来收集实验中产生的气体的装置,但未将导管画全,请在图上把导管补充完整.
(2)实验中他们取6.4g 铜片和12mL 18mol?L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余.
①写出铜跟浓硫酸反应的化学方程式:
②有一定量的余酸但未能使铜片完全溶解,你认为其中原因是
(3)为定量测定余酸的物质的量浓度,该小组学生进行了如下设计:
先测定铜与浓硫酸反应产生的SO2的量,再计算余酸的物质的量浓度.他们认为测定二氧化硫的量的方法有多种,你认为下列实验方案中可行的是
A.将装置A产生的气体缓缓通过预先称量过的盛有碱石灰的干燥管,结束反应后再次称量
B.将装置A产生的气体缓缓通入足量用稀硫酸酸化的高锰酸钾溶液,再加入足量氯化钡溶液,过滤、洗涤、干燥、称量沉淀
C.用排水法测定装置A产生气体的体积(已折算成标准状况)
D.将装置A产生的气体缓缓通入足量氢氧化钡溶液,反应完全后,过滤、洗涤、干燥、称量沉淀
E.将装置A产生的气体缓缓通入足量硝酸酸化的硝酸钡溶液,反应完全后,过滤、洗涤、干燥、称量沉淀
请你对不可行的方案中选出一例进行分析:
(4)请你再设计一种其他可行的实验方案,来测定余酸的物质的量浓度,简要写出操作步骤及需要测定的数据(不必计算)
合理膳食,保持营养均衡,正确用药,保持身体健康,是青少年学生健康成长的重要保证.
(1)维生素C能增强人体对疾病的抵抗能力,促进人体生长发育,中学生每天要补充60mg的维生素C.下列物质含有丰富维生素C的是
A.牛肉 B.辣椒 C.鸡蛋
(2)青少年及成人缺乏某种微量元素将导致甲状腺肿大,而且会造成智力损害,该微量元素是 (填字母)
(3)蛋白质是人体必需的营养物质,它在人体内最终分解为
A.葡萄糖 B.氨基酸 C.脂肪酸
(4)黄金搭档广告语说:“维C和Fe搭档效果会更好!”是因为服用维生素C,可使食物中的Fe3+还原成Fe2+,有利于人体吸收.说明维生素C在这一反应中具有
(5)市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸的作用下转化成亚铁盐.此反应的离子方程式为
查看习题详情和答案>>
(1)维生素C能增强人体对疾病的抵抗能力,促进人体生长发育,中学生每天要补充60mg的维生素C.下列物质含有丰富维生素C的是
B
B
(填字母).A.牛肉 B.辣椒 C.鸡蛋
(2)青少年及成人缺乏某种微量元素将导致甲状腺肿大,而且会造成智力损害,该微量元素是 (填字母)
A
A
. A.碘 B.铁 C.钙(3)蛋白质是人体必需的营养物质,它在人体内最终分解为
B
B
(填字母).A.葡萄糖 B.氨基酸 C.脂肪酸
(4)黄金搭档广告语说:“维C和Fe搭档效果会更好!”是因为服用维生素C,可使食物中的Fe3+还原成Fe2+,有利于人体吸收.说明维生素C在这一反应中具有
还原性
还原性
性;维生素C可用于防治坏血
坏血
病.(5)市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸的作用下转化成亚铁盐.此反应的离子方程式为
Fe+2HCl═FeCl2+H2↑
Fe+2HCl═FeCl2+H2↑
.我国柴达木盆地拥有丰富的盐矿资源,液体矿床以钾矿为主,伴生着镁、溴等多种矿产.工业上取盐湖苦卤的浓缩液(富含K+、Mg2+、Br-、SO42-、Cl-等),来制取较纯净的氯化钾晶体及液溴(Br2),工业流程如图1:

请根据以上流程,回答相关问题:
(1)操作①需要的玻璃仪器有 .
(2)参照图2溶解度曲线,有人认为固体B是氯化钾,有人说是氯化镁,请说出你的观点和支撑你观点的理由: .
(3)同学甲模仿实验室中粗盐提纯的操作,对上述操作②后无色液体设计了除杂提纯实验方案,也可制得较纯净的氯化钾晶体.其方案流程如下:

有关资料:
(i)该方案中的无色溶液就是操作②后无色液体,混合液A的主要成分是 .(填化学式)有人认为用一种试剂 (填化学式)就可以起到混合液A的作用,你的观点是 .
(ii)有同学提出从经济上考虑可以用石灰乳代替试剂A进行实验,经讨论,其他同学一致认为该提议不可行,他们的理由是 .
(ⅲ)实验过程中,若要确保Mg2+完全除尽,用广泛pH试纸测定溶液的pH应≥ .(若离子浓度小于10-5mol?L-1可视作已被完全除尽).
(ⅳ)对溶液B加热并不断滴加1 mol?L一1的盐酸溶液,同时用pH试纸检测溶液,直至pH=5时停止加盐酸,得到溶液C.由溶液C得到固体C的操作名称是 .
(v)工业流程中也可以获得氯化镁的溶液,从中可以提取金属材料镁.方法是:加热蒸发氯化镁的溶液得到MgCl2?6H2O,在 中加热使其失去结晶水得到MgCl2,电解就可以得到金属镁.
查看习题详情和答案>>

请根据以上流程,回答相关问题:
(1)操作①需要的玻璃仪器有
(2)参照图2溶解度曲线,有人认为固体B是氯化钾,有人说是氯化镁,请说出你的观点和支撑你观点的理由:
(3)同学甲模仿实验室中粗盐提纯的操作,对上述操作②后无色液体设计了除杂提纯实验方案,也可制得较纯净的氯化钾晶体.其方案流程如下:

有关资料:
| 化学式 | Ca(OH)2 | CaSO4 | BaCO3 | BaSO4 | MgCO3 | Mg(OH)2 |
| Ksp | 1.0×10一4 | 7.1×10一5 | 8.1×10一9 | 1.08×10一10 | 3.5×10一5 | 1.6×10一11 |
(ii)有同学提出从经济上考虑可以用石灰乳代替试剂A进行实验,经讨论,其他同学一致认为该提议不可行,他们的理由是
(ⅲ)实验过程中,若要确保Mg2+完全除尽,用广泛pH试纸测定溶液的pH应≥
(ⅳ)对溶液B加热并不断滴加1 mol?L一1的盐酸溶液,同时用pH试纸检测溶液,直至pH=5时停止加盐酸,得到溶液C.由溶液C得到固体C的操作名称是
(v)工业流程中也可以获得氯化镁的溶液,从中可以提取金属材料镁.方法是:加热蒸发氯化镁的溶液得到MgCl2?6H2O,在
下列是模拟石油深加工来合成CH2=CHCOOCH2CH3(丙烯酸乙酯)等物质的过程:
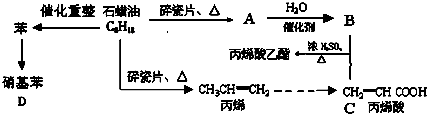
请回答下列问题:
(1)A的结构简式为:
(2)CH2=CHCOOCH2CH3的含氧官能团 (填名称)
(3)写出下列化学反应方程式
①B+C→CH2=CHCOOCH2CH3:
②丙烯→聚丙烯: ③苯→硝基苯如何加热?: .其优点是 .
(4)目前制备酒精的方法有两种:
方法一:A+HBr→CH3-CH2Br CH3-CH2Br+H2O
CH3CH2OH+HBr
方法二:(C6H10O5)n(淀粉)+nH2O
nM M
2C2H5OH+2CO2
①对方法一所涉及的有机反应类型分别为: ,
②对于方法二,M的分子式为:
③下列说法正确的是 (填代号)
A、从绿色化学的角度看方法一的原子利用率100%
B、从原料的可再生性来说,方法二最好
C、方法二产物乙醇储藏的化学能来自于太阳能. 查看习题详情和答案>>

请回答下列问题:
(1)A的结构简式为:
(2)CH2=CHCOOCH2CH3的含氧官能团
(3)写出下列化学反应方程式
①B+C→CH2=CHCOOCH2CH3:
②丙烯→聚丙烯:
(4)目前制备酒精的方法有两种:
方法一:A+HBr→CH3-CH2Br CH3-CH2Br+H2O
| NaOH |
| △ |
方法二:(C6H10O5)n(淀粉)+nH2O
| 淀粉酶 |
| 酒化酶 |
①对方法一所涉及的有机反应类型分别为:
②对于方法二,M的分子式为:
③下列说法正确的是
A、从绿色化学的角度看方法一的原子利用率100%
B、从原料的可再生性来说,方法二最好
C、方法二产物乙醇储藏的化学能来自于太阳能. 查看习题详情和答案>>
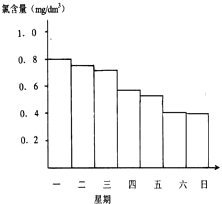 游泳池水的含氯量应该控制在0.5mg/L至1.0mg/L之间,
游泳池水的含氯量应该控制在0.5mg/L至1.0mg/L之间,(1)写出氯气溶于水的方程式
Cl2+H2O=HCl+HClO
Cl2+H2O=HCl+HClO
.溶于水中的哪种物质可杀菌消毒HClO
HClO
.(2)如图显示一星期中每天19时泳池中水的氯含量,哪几天使用泳池不安全
星期六、星期日
星期六、星期日
.(3)你认为哪几天的天气炎热、阳光强烈
星期四到星期六
星期四到星期六
,说出一种理由是天气炎热、日光强烈水温升高,次氯酸在强光照射下分解加快,故氯的含量降低较大
天气炎热、日光强烈水温升高,次氯酸在强光照射下分解加快,故氯的含量降低较大
.(4)若把一片紫色的花瓣放入氯水中,可观察到现象
紫色花瓣先变红,后褪色
紫色花瓣先变红,后褪色
.(5)若游泳池蓄水1200000L,要使星期日的氯含量回复到0.8mg/L,需加入
480
480
g的氯气,需要加入162.2
162.2
L的氯气(在常压和室温下测量).(6)小型泳池通常使用次氯酸钠溶液而非氯气来消毒池水,试举出使用次氯酸钠溶液而非氯气的一项理由
次氯酸钠溶液比较稳定,容易储运
次氯酸钠溶液比较稳定,容易储运
.用化学方程式说明工业上如何生产次氯酸钠溶液Cl2+2NaOH=NaClO+NaCl+H2O
Cl2+2NaOH=NaClO+NaCl+H2O
.(在常压和室温下,气体摩尔体积为24.0L/mol).