题目内容
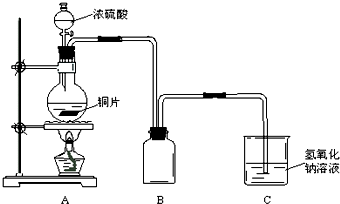
某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用如图所示装置先进行了有关实验: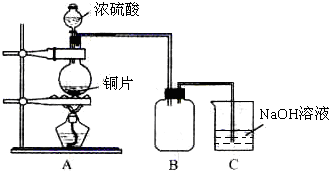
(1)B是用来收集实验中产生的气体的装置,但未将导管画全,请在图上把导管补充完整.
(2)实验中他们取6.4g 铜片和12mL 18mol?L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余.
①写出铜跟浓硫酸反应的化学方程式:
②有一定量的余酸但未能使铜片完全溶解,你认为其中原因是
(3)为定量测定余酸的物质的量浓度,该小组学生进行了如下设计:
先测定铜与浓硫酸反应产生的SO2的量,再计算余酸的物质的量浓度.他们认为测定二氧化硫的量的方法有多种,你认为下列实验方案中可行的是
A.将装置A产生的气体缓缓通过预先称量过的盛有碱石灰的干燥管,结束反应后再次称量
B.将装置A产生的气体缓缓通入足量用稀硫酸酸化的高锰酸钾溶液,再加入足量氯化钡溶液,过滤、洗涤、干燥、称量沉淀
C.用排水法测定装置A产生气体的体积(已折算成标准状况)
D.将装置A产生的气体缓缓通入足量氢氧化钡溶液,反应完全后,过滤、洗涤、干燥、称量沉淀
E.将装置A产生的气体缓缓通入足量硝酸酸化的硝酸钡溶液,反应完全后,过滤、洗涤、干燥、称量沉淀
请你对不可行的方案中选出一例进行分析:
(4)请你再设计一种其他可行的实验方案,来测定余酸的物质的量浓度,简要写出操作步骤及需要测定的数据(不必计算)
分析:(1)二氧化硫的密度比空气的大,排空气法收集时长进短处;
(2)①铜与浓硫酸在加热条件下生成硫酸铜、二氧化硫和水;
②随着反应的进行,浓硫酸逐渐成为稀硫酸,而铜与稀硫酸不反应;
(3)A、碱石灰除吸收二氧化硫外还能吸收水,测得二氧化硫质量增大;
B、高锰酸钾溶液中含有硫酸,与氯化钡反应生成沉淀增大;
C、二氧化硫在水中以1:40溶解,收集二氧化硫体积减少;
D、亚硫酸钡在空气中烘干及称重过程中部分被氧化生成硫酸钡,产生固体质量增大;
E、二氧化硫通入足量硝酸酸化的硝酸钡溶液,生成硫酸钡沉淀,通过S元素守恒,通过硫酸钡的质量计算二氧化硫的量;
(4)可利用剩余的稀硫酸与锌反应放出氢气,通过氢气的量计算剩余硫酸的物质的量浓度.
(2)①铜与浓硫酸在加热条件下生成硫酸铜、二氧化硫和水;
②随着反应的进行,浓硫酸逐渐成为稀硫酸,而铜与稀硫酸不反应;
(3)A、碱石灰除吸收二氧化硫外还能吸收水,测得二氧化硫质量增大;
B、高锰酸钾溶液中含有硫酸,与氯化钡反应生成沉淀增大;
C、二氧化硫在水中以1:40溶解,收集二氧化硫体积减少;
D、亚硫酸钡在空气中烘干及称重过程中部分被氧化生成硫酸钡,产生固体质量增大;
E、二氧化硫通入足量硝酸酸化的硝酸钡溶液,生成硫酸钡沉淀,通过S元素守恒,通过硫酸钡的质量计算二氧化硫的量;
(4)可利用剩余的稀硫酸与锌反应放出氢气,通过氢气的量计算剩余硫酸的物质的量浓度.
解答: 解:(1)铜与浓硫酸在加热条件下生成二氧化硫气体,二氧化硫的密度比空气的大,排空气法收集时长进短处,
解:(1)铜与浓硫酸在加热条件下生成二氧化硫气体,二氧化硫的密度比空气的大,排空气法收集时长进短处,
故答案为: ;
;
(2)①铜与浓硫酸在加热条件下生成硫酸铜、二氧化硫和水,化学方程式为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O;
②铜与浓硫酸在加热条件下可以发生反应,而铜与稀硫酸不反应,随着反应的进行,硫酸浓度浓度降低,当浓硫酸逐渐成为稀硫酸时反应停止,
故答案为:随着反应进行,硫酸被消耗,浓硫酸变成稀硫酸,稀硫酸和铜不反应;
(3)A、碱石灰除吸收二氧化硫外还能吸收水,测得二氧化硫质量增大,导致余酸的物质的量浓度偏低;
B、高锰酸钾溶液中含有硫酸,与氯化钡反应生成沉淀增大,导致余酸的物质的量浓度偏低;
C、二氧化硫在水中以1:40溶解,收集二氧化硫体积减少,导致余酸的物质的量浓度偏高;
D、亚硫酸钡在空气中烘干及称重过程中部分被氧化生成硫酸钡,产生固体质量增大,导致余酸的物质的量浓度偏低;
E、二氧化硫通入足量硝酸酸化的硝酸钡溶液,生成硫酸钡沉淀,通过S元素守恒,通过硫酸钡的质量计算二氧化硫的量;
综上所述,实验方案中可行的是E,
故答案为:E;方案序号A,原因:碱石灰除吸收二氧化硫外还能吸收水,测得二氧化硫质量增大,导致结果:偏低;
(4)Zn和稀硫酸反应生成氢气,因此可向反应后溶液中加入足量的锌粒,收集并测定氢气的体积,通过氢气量计算剩余硫酸的物质的量浓度,
故答案为:①取反应后溶液,向其中加入足量锌;②收集并测定氢气的体积;③通过氢气量计算剩余硫酸的物质的量浓度.
 解:(1)铜与浓硫酸在加热条件下生成二氧化硫气体,二氧化硫的密度比空气的大,排空气法收集时长进短处,
解:(1)铜与浓硫酸在加热条件下生成二氧化硫气体,二氧化硫的密度比空气的大,排空气法收集时长进短处,故答案为:
 ;
;(2)①铜与浓硫酸在加热条件下生成硫酸铜、二氧化硫和水,化学方程式为:Cu+2H2SO4(浓)
| ||
故答案为:Cu+2H2SO4(浓)
| ||
②铜与浓硫酸在加热条件下可以发生反应,而铜与稀硫酸不反应,随着反应的进行,硫酸浓度浓度降低,当浓硫酸逐渐成为稀硫酸时反应停止,
故答案为:随着反应进行,硫酸被消耗,浓硫酸变成稀硫酸,稀硫酸和铜不反应;
(3)A、碱石灰除吸收二氧化硫外还能吸收水,测得二氧化硫质量增大,导致余酸的物质的量浓度偏低;
B、高锰酸钾溶液中含有硫酸,与氯化钡反应生成沉淀增大,导致余酸的物质的量浓度偏低;
C、二氧化硫在水中以1:40溶解,收集二氧化硫体积减少,导致余酸的物质的量浓度偏高;
D、亚硫酸钡在空气中烘干及称重过程中部分被氧化生成硫酸钡,产生固体质量增大,导致余酸的物质的量浓度偏低;
E、二氧化硫通入足量硝酸酸化的硝酸钡溶液,生成硫酸钡沉淀,通过S元素守恒,通过硫酸钡的质量计算二氧化硫的量;
综上所述,实验方案中可行的是E,
故答案为:E;方案序号A,原因:碱石灰除吸收二氧化硫外还能吸收水,测得二氧化硫质量增大,导致结果:偏低;
(4)Zn和稀硫酸反应生成氢气,因此可向反应后溶液中加入足量的锌粒,收集并测定氢气的体积,通过氢气量计算剩余硫酸的物质的量浓度,
故答案为:①取反应后溶液,向其中加入足量锌;②收集并测定氢气的体积;③通过氢气量计算剩余硫酸的物质的量浓度.
点评:本题考查浓硫酸与铜的反应,侧重于实验装置、反应原理和实验设计的考查,其中误差分析是难点,试题开放性强,答案不唯一.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目

 某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用图所示装置进行有关实验.请回答:
某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用图所示装置进行有关实验.请回答: 某化学课外兴趣小组为探究苯与溴发生反应的反应类型并制取纯净的溴苯,进行如下实验.请根据要求回答相关问题.
某化学课外兴趣小组为探究苯与溴发生反应的反应类型并制取纯净的溴苯,进行如下实验.请根据要求回答相关问题.