网址:http://m.1010jiajiao.com/timu3_id_164860[举报]
乙醇在能源、生产及日常生活等许多方面都有十分广泛的应用。请计算:
(1)将足量乙醇与9.2 g金属钠充分反应,则标准状况下生成气体的体积是 L
(2)若一定量的乙醇和O2在密闭容器中燃烧后的产物为CO2、CO和H2O(g)。产物依次经过浓硫酸和碱石灰使其被充分吸收,浓硫酸增重10.8 g,碱石灰增重13.2 g。则氧气的物质的量是 mol,燃烧产物的平均摩尔质量是 g/mol。
高中阶段常用化学反应方程式
- 钠在空气中燃烧(黄色的火焰)
- 钠与水反应(浮、熔、游、响、红)
- 过氧化钠与水的反应
- 过氧化钠与二氧化碳的反应
- 苏打(纯碱)与盐酸反应
- 小苏打受热分解
- *固体氢氧化钠、碳酸氢钠混合物在密闭容器中加热
- 金属锂在空气中燃烧
- 铜丝在氯气中剧烈燃烧(棕色烟)
- 铁在氯气中剧烈燃烧
- 氢气在氯气中燃烧(苍白色火焰,瓶口白雾)
- 氯气溶于水及新制氯水的成分:
- 次氯酸见光分解(强氧化剂、杀菌消毒、漂白剂)
- 工业制漂白粉原理
- 氯气实验室制法(主仪器:分液漏斗、圆底烧瓶等)
- 新制氯水注入盛溴化钠溶液的试管中
- 用电子式表示溴化镁、氯化氢分子的形成
- 铁与硫加热反应
- 硫化氢充分燃烧
- 硫化氢不完全燃烧
- 硫化亚铁与稀盐酸反应
- 二氧化硫制三氧化硫(无色固体,熔点16.8℃,44.8℃)
- 浓硫酸与铜反应
- 浓硫酸与非金属碳的反应
- 工业制单质硅(碳在高温下还原二氧化硅)
- 二氧化硅与氢氧化钠反应
- 氮气和氢气反应
- 氮气与氧气放电条件下反应
- 二氧化氮溶于水
- NO2、O2混合气通入水中无剩余气体
- 一定量的NO、O2混合通入水中无剩余气体
- 五氧化二磷与热水反应
- 磷在氯气中充分燃烧
- 氨的催化氧化
- 碳酸氢铵受热分解
- 用浓盐酸检验氨气(白烟生成)
- 硫酸铵溶液与氢氧化钠溶液混合加热
- 硝酸铵溶液与氢氧化钠溶液混合(不加热)
- 铝箔在氧气中剧烈燃烧
- 铝片与稀盐酸反应
- 铝与氢氧化钠溶液反应
- 铝与三氧化二铁高温下反应(铝热反应)
- 镁在二氧化碳中燃
- 氧化铝溶于氢氧化钠溶液
- 硫酸铝溶液中滴过量氨水
- 氢氧化铝溶液中加盐酸
- *高温下铁与水反应
- 铁与盐酸反应
- 氧化铁溶于盐酸中
- 化铁中滴入氢氧化钠溶液(红褐色沉淀)
- 氢氧化亚铁在空气中氧化
- 氯化亚铁溶液中通入氯气
- 氯化铁溶液中加入铁粉
- 甲烷与氯气取代生成四氯化碳
- 乙烯实验室制法(浓硫酸作催化剂,脱水剂)
- 乙烯通入溴水中
- 制取聚乙烯、聚丙烯
- 乙制取
- 由乙炔制聚乙烯
- 与液溴反应(需铁作催化剂)
- 苯的硝化反应
- 与氢气加成生成环己烷
- 甲苯发生硝化反应
- 乙烷水解
- 乙烷消去反应
- 醇与钠反应
- 乙醇催化氧化
- 苯酚与氢氧化钠溶液反应
- 苯酚钠溶液中通入二氧化碳
- 苯酚的定性检验定量测定方法:
- 醛制1-丙醇
- 醛制乙酸
- 乙醛的银镜反应
- 醛与新制氢氧化铜悬浊液
- *乙酸与氢氧化铜悬浊液
- 酸乙酯制取(用饱和碳酸钠溶液收集)
- 葡萄糖结构简式
- 蔗水解方程式
- 淀粉水解
- 硬脂酸甘油酯皂化反应
我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法.
I. 已知:2CO(g)+ O2(g)=2CO2(g),ΔH=-566 kJ·mol-1
2Fe(s)+ 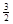 O2(g)=Fe2O3(s),ΔH=-825.5 kJ·mol-1
O2(g)=Fe2O3(s),ΔH=-825.5 kJ·mol-1 反应:Fe2O3(s)+ 3CO(g)
反应:Fe2O3(s)+ 3CO(g) 2Fe(s)+ 3CO2(g),ΔH=______ kJ·mol-1.
2Fe(s)+ 3CO2(g),ΔH=______ kJ·mol-1.
Ⅱ. 反应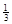 Fe2O3(s)+ CO(g)
Fe2O3(s)+ CO(g)
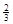 Fe(s)+ CO2(g)在1000℃的平衡常数等于4.在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡.
Fe(s)+ CO2(g)在1000℃的平衡常数等于4.在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡.
(1)CO的平衡转化率=____________.
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是________.
a.提高反应温度
b.增大反应体系的压强
c.选取合适的催化剂
d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
Ⅲ.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:
CO(g)+ 2H2(g) CH3OH(g).请根据图示回答下列问题:
CH3OH(g).请根据图示回答下列问题: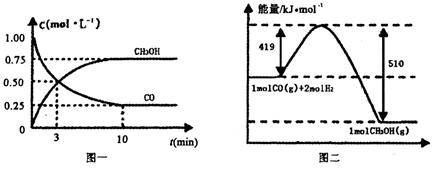
(1)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=________.
(2)若在温度和容器相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡吋的有关数据如下表:
| 容器 | 反应物投入的量 | 反应物的 转化率 | CH3OH的浓度 | 能量变化 (Q1、Q2、Q3均大于0) |
| 甲 | 1mol CO和2mol H2 | α1 | c1 | 放出Q1kJ热量 |
| 乙 | 1mol CH3OH | α2 | c2 | 吸收Q2kJ热量 |
| 丙 | 2mol CO和4mol H2 | α3 | c3 | 放出Q3kJ热量 |
则下列关系正确的是________.
A.c1=c2
B.2Q1=Q3
C.2a1=a3
D.a1 +a2 =1
E.该反应若生成1mol CH3OH,则放出(Q1+Q2)kJ热量
(3)若在一体积可变的密闭容器中充入l molCO、2molH2和1molCH3OH,达到平衡吋测得混合气体的密度是同温同压下起始的1.6倍,则该反应向________(填“正”、“逆”)反应方向移动.
(4)甲醇可与氧气构成燃料电池,该电池用多孔的惰性电极浸入浓氢氧化钾溶液,写出该电池的负极反应式______________________. 查看习题详情和答案>>
我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法.
I. 已知:2CO(g)+ O2(g)=2CO2(g),ΔH=-566 kJ·mol-1
2Fe(s)+ 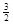 O2(g)=Fe2O3(s),ΔH=-825.5
kJ·mol-1
O2(g)=Fe2O3(s),ΔH=-825.5
kJ·mol-1
 反应:Fe2O3(s)+
3CO(g)
反应:Fe2O3(s)+
3CO(g)  2Fe(s)+ 3CO2(g),ΔH=______ kJ·mol-1.
2Fe(s)+ 3CO2(g),ΔH=______ kJ·mol-1.
Ⅱ. 反应
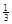 Fe2O3(s)+ CO(g)
Fe2O3(s)+ CO(g)
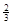 Fe(s)+ CO2(g)在1000℃的平衡常数等于4.在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡.
Fe(s)+ CO2(g)在1000℃的平衡常数等于4.在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡.
(1)CO的平衡转化率=____________.
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是________.
a.提高反应温度
b.增大反应体系的压强
c.选取合适的催化剂
d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
Ⅲ.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:
CO(g)+
2H2(g)  CH3OH(g).请根据图示回答下列问题:
CH3OH(g).请根据图示回答下列问题:
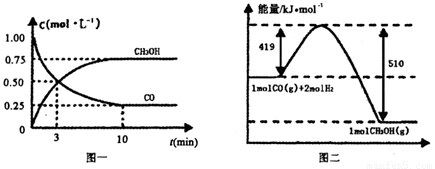
(1)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=________.
(2)若在温度和容器相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡吋的有关数据如下表:
|
容器 |
反应物投入的量 |
反应物的 转化率 |
CH3OH的浓度 |
能量变化 (Q1、Q2、Q3均大于0) |
|
甲 |
1mol CO和2mol H2 |
α1 |
c1 |
放出Q1kJ热量 |
|
乙 |
1mol CH3OH |
α2 |
c2 |
吸收Q2kJ热量 |
|
丙 |
2mol CO和4mol H2 |
α3 |
c3 |
放出Q3kJ热量 |
则下列关系正确的是________.
A.c1=c2
B.2Q1=Q3
C.2a1=a3
D.a1 +a2 =1
E.该反应若生成1mol CH3OH,则放出(Q1+Q2)kJ热量
(3)若在一体积可变的密闭容器中充入l molCO、2molH2和1molCH3OH,达到平衡吋测得混合气体的密度是同温同压下起始的1.6倍,则该反应向________(填“正”、“逆”)反应方向移动.
(4)甲醇可与氧气构成燃料电池,该电池用多孔的惰性电极浸入浓氢氧化钾溶液,写出该电池的负极反应式______________________.
查看习题详情和答案>>
.(13分)我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法.
I.已知:2CO(g)+ O2(g)=2CO2(g),ΔH=-566 kJ·mol-1
2Fe(s)+
 O2(g)=Fe2O3(s),ΔH=-825.5 kJ·mol-1
O2(g)=Fe2O3(s),ΔH=-825.5 kJ·mol-1
反应:Fe2O3(s)+
3CO(g) 2Fe(s)+ 3CO2(g),ΔH=______ kJ·mol-1.
2Fe(s)+ 3CO2(g),ΔH=______ kJ·mol-1.
Ⅱ.反应 1/3Fe2O3(s)+
CO(g) 2/3Fe(s)+ CO2(g)在1000℃的平衡常数等于4.在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡.
2/3Fe(s)+ CO2(g)在1000℃的平衡常数等于4.在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡.
(1)CO的平衡转化率=____________.
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是________.
a.提高反应温度 b.增大反应体系的压强
c.选取合适的催化剂 d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
Ⅲ.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:
CO(g)+
2H2(g) CH3OH(g).请根据图示回答下列问题:
CH3OH(g).请根据图示回答下列问题:

(1)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=________.
(2)若在温度和容器相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡吋的有关数据如下表:
|
容器 |
反应物投入的量 |
反应物的 转化率 |
CH3OH的浓度 |
能量变化 (Q1、Q2、Q3均大于0) |
|
甲 |
1mol CO和2mol H2 |
α1 |
c1 |
放出Q1 kJ热量 |
|
乙 |
1mol CH3OH |
α2 |
c2 |
吸收Q2 kJ热量 |
|
丙 |
2mol CO和4mol H2 |
α3 |
c3 |
放出Q3 kJ热量 |
则下列关系正确的是________.
A c1=c2 B.2Q1=Q3 C. 2α1=α2 D. α1+α2=1
E. 该反应若生成1mol CH3OH,则放出(Q1+Q2)kJ热量
(3)若在一体积可变的密闭容器中充入l mol CO、2mol H2和1mol CH3OH,达到平衡吋测得混合气体的密度是同温同压下起始的1.6倍,则该反应向________(填“正”、“逆”)反应方向移动.
(4)甲醇可与氧气构成燃料电池,该电池用多孔的惰性电极浸入浓氢氧化钾溶液,写出该电池的负极反应式___ ____。
查看习题详情和答案>>