网址:http://m.1010jiajiao.com/timu3_id_164399[举报]
 已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去).
已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去).(1)若A和E为单质,组成A单质的元素是自然界中形成化合物种类最多的元素.
①B属于分子
②向50mL 4mol/L的NaOH溶液中通入1.12L B(标准状况),反应后溶液中溶质的物质的量之比为
③4g A单质完全燃烧放出131.2kJ的热量,写出表示A单质燃烧热的热化学方程式
(2)若A为第三周期中的元素所形成的氯化物.
①写出A溶液→B的离子方程式
②写出A和B的溶液反应的离子方程式
(3)若A为常见的金属,在E的冷、浓溶液中,A有钝化现象.已知:X为含有非极键的离子化合物,且1mol X含有38mol电子,向D溶液中加入与D等物质的量的X固体,恰好完全反应,写出该反应的离子方程式

上述转化关系中除②③⑤外,其余均在溶液中进行,且部分反应物、生成物均被略去.已知X、Y为非金属单质,X为黄色粉末,Z为常见金属,F、G、Y为气体,D是一种酸,H为蓝色絮状沉淀,I为深蓝色晶体.工业上常利用反应②炼制Z,利用反应③④制备A,一定量C经反应②③完全得到E时,质量不变.A、D、I溶液滴加BaCl2溶液均产生白色沉淀,B的焰色反应呈黄色.试填空:
(1)写出C、I的化学式
(2)用电子式表示G的形成过程
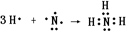
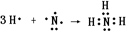
(3)用惰性电极电解A溶液的离子方程式为
| ||
| ||
(4)F气体具有漂白性,其漂白原理为
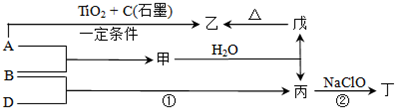
请回答:
(1)单质B的组成元素在周期表中的位置是
(2)丁中所包含的化学键类型有
a.离子键 b.极性共价键 c.非极性共价键
(3)反应①的化学方程式为
| 催化剂 |
| 高温高压 |
| 催化剂 |
| 高温高压 |
(4)反应②中,0.5mol NaClO参加反应时,转移1mol电子,其化学方程式为
(5)-定条件下,A与TiO2、C(石墨)反应只生成乙和碳化钛(TiC),二者均为某些高温结构陶瓷的主要成分.已知,该反应生成1mol乙时放出536kJ热量,其热化学方程式为
(13分)下表为长式周期表的一部分,其中的编号代表对应的元素。
请回答下列问题:
(1)元素⑩的基态原子的价电子排布式为 。
(2)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如图所示(图中②、④、⑨分别位于晶胞的体心、顶点、面心),则该化合物的化学式为 (用对应的元素符号表示),与④距离相等且最近的⑨有 个。
(3)元素②的一种氢化物(分子中含有6个原子)是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志。有关该氢化物分子的说法正确的是 。
A.分子中含有分子间的氢键
B.属于含有极性键的非极性分子
C.只含有4个sp1-s的σ键和1个p-p的π键
D.该氢化物分子中②原子采用sp2杂化
(4)下图所示为血红蛋白和肌红蛋白的活性部分(血红素)的结构式。此结构片段中含有的化学键有 (填序号)。
A.离子键 B.金属键 C.极性键 D.非极性键
E.配位键 F.氢键 G.σ键 H.π键
(5)下表为原子序数依次增大的短周期元素A~F的第一到第五电离能数据。
请回答:表中的金属元素是 (填字母);若A、B、C为原子序数依次增大的同周期相邻元素,表中显示B比A和C的第一电离能都略大,其原因是
。
(13分)下表为长式周期表的一部分,其中的编号代表对应的元素。

请回答下列问题:
(1)元素⑩的基态原子的价电子排布式为 。
(2)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如图所示(图中②、④、⑨分别位于晶胞的体心、顶点、面心),则该化合物的化学式为 (用对应的元素符号表示),与④距离相等且最近的⑨有 个。

(3)元素②的一种氢化物(分子中含有6个原子)是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志。有关该氢化物分子的说法正确的是 。
A.分子中含有分子间的氢键
B.属于含有极性键的非极性分子
C.只含有4个sp1-s的σ键和1个p-p的π键
D.该氢化物分子中②原子采用sp2杂化
(4)下图所示为血红蛋白和肌红蛋白的活性部分(血红素)的结构式。此结构片段中含有的化学键有 (填序号)。

A.离子键 B.金属键 C.极性键 D.非极性键
E.配位键 F.氢键 G.σ键 H.π键
(5)下表为原子序数依次增大的短周期元素A~F的第一到第五电离能数据。

请回答:表中的金属元素是 (填字母);若A、B、C为原子序数依次增大的同周期相邻元素,表中显示B比A和C的第一电离能都略大,其原因是
。
查看习题详情和答案>>