摘要:氨气的性质 :氨气易溶于水.溶于水显碱性.能使湿润的红色石蕊试纸变蓝.氨水易挥发.不易运输.但成本低.氨水应在阴凉处保存.雨天.烈日下不宜施用氨态氮肥. 与酸的反应 NH3 +HCl===NH4Cl 2NH3+H2SO4===(NH4)2SO4 ▲ 盐:固态.易分解.易溶于水.与碱反应.产生而挥发.比易于保存和运输.但成本更高.Cl-不被植物吸收.在土壤中积累.影响植物生长.不能在碱性土壤中使用.不能雨天使用. NH4Cl===NH3↑+HCl↑(加热分解NH4Cl晶体) 喷泉实验:(1).实验装置的工作原理?(2).溶液变红色的原因?(3).喷泉的发生应具备什么条件?
网址:http://m.1010jiajiao.com/timu3_id_164302[举报]
氨气是一种无色、有特殊刺激性气味的气体,氨气极易液化和极易溶于水,且能使红色石蕊试纸变蓝.某校研究性学习小组设计实验欲制取氨气并探究其性质.
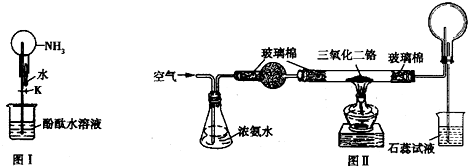
请回答下列问题:
(1)用氯化铵与消石灰共热制取氨气的化学方程式为 .
(2)图Ⅰ是进行氨气喷泉实验的装置,形成喷泉的操作步骤是 .
(3)学生甲和乙在相同环境下分别进行氨气喷泉实验,学生甲实验时,涌入烧瓶中的酚酞水溶液的体积占烧瓶容积的
,学生乙实验时,涌入烧瓶中的酚酞水溶液的体积占烧瓶容积的
,假设烧瓶内的溶液没有损失,学生甲和乙制得的氨水的物质的量浓度之比为 .
(4)氨气在空气中不能燃烧,为了探究在催化剂存在时氨气能否被空气中的氧气氧化,该小组进行如图Ⅱ所示的实验.
①实验时,先加热硬质玻璃管至三氧化二铬红热,并鼓入空气.停止加热后再继续鼓入空气,三氧化二铬保持红热,原因是 .
②氨催化氧化的化学方程式为 .
③整个实验过程中,不会生成的物质是 (填序号).
A.N2 B.NO2 C.HNO3?D.NH4NO3? 查看习题详情和答案>>

请回答下列问题:
(1)用氯化铵与消石灰共热制取氨气的化学方程式为
(2)图Ⅰ是进行氨气喷泉实验的装置,形成喷泉的操作步骤是
(3)学生甲和乙在相同环境下分别进行氨气喷泉实验,学生甲实验时,涌入烧瓶中的酚酞水溶液的体积占烧瓶容积的
| 4 |
| 5 |
| 1 |
| 5 |
(4)氨气在空气中不能燃烧,为了探究在催化剂存在时氨气能否被空气中的氧气氧化,该小组进行如图Ⅱ所示的实验.
①实验时,先加热硬质玻璃管至三氧化二铬红热,并鼓入空气.停止加热后再继续鼓入空气,三氧化二铬保持红热,原因是
②氨催化氧化的化学方程式为
③整个实验过程中,不会生成的物质是
A.N2 B.NO2 C.HNO3?D.NH4NO3? 查看习题详情和答案>>
(1)氨易溶于水的原因是 ; .(写出两点即可)
(2)化学上有一种见解,认为含氧酸的通式可写成(HO)mROn,如果成酸元素R相同,则n值越大,酸性越 (填“强”或“弱”).以下各种含氧酸HClO、HClO3、H2SO3、HClO4的酸性由强到弱排列为 .
(3)熔点、沸点HF HI(填“>”或“<”);原因: .
(4)下列4种物质熔点沸点由高到低排列为 (填序号)
①金刚石(C-C) ②锗(Ge-Ge) ③晶体硅(Si-Si) ④金刚砂(Si-C)
(5)为了减缓温室效应,科学家设计反应:CO2+4H2→CH4+2H2O以减小空气中CO2.若有1mol CH4生成,则有 mol σ键和 mol π键断裂.
查看习题详情和答案>>
(2)化学上有一种见解,认为含氧酸的通式可写成(HO)mROn,如果成酸元素R相同,则n值越大,酸性越
(3)熔点、沸点HF
(4)下列4种物质熔点沸点由高到低排列为
①金刚石(C-C) ②锗(Ge-Ge) ③晶体硅(Si-Si) ④金刚砂(Si-C)
(5)为了减缓温室效应,科学家设计反应:CO2+4H2→CH4+2H2O以减小空气中CO2.若有1mol CH4生成,则有
(1)氨气极易溶于水,氨气与水反应的化学方程式为 ;氨水显碱性的原因是 (用离子方程式表示).
(2)在6份0.01mol/L的氨水中分别加入下列物质:
A.浓氨水B.纯水C.少量K2CO3 D.少量浓硫酸 E.少量NaOH固体 F.少量Al2(SO4)3固体.
①能使c(OH-)减少、c(NH4+)增大的是 .
②能使c(OH-)增大、c(NH4+)减少的是 .
③能使c(OH-)和c(NH4+)都增大的是 .
④能使c(OH-)和c(NH4+)都减少的是 .
查看习题详情和答案>>
(2)在6份0.01mol/L的氨水中分别加入下列物质:
A.浓氨水B.纯水C.少量K2CO3 D.少量浓硫酸 E.少量NaOH固体 F.少量Al2(SO4)3固体.
①能使c(OH-)减少、c(NH4+)增大的是
②能使c(OH-)增大、c(NH4+)减少的是
③能使c(OH-)和c(NH4+)都增大的是
④能使c(OH-)和c(NH4+)都减少的是