网址:http://m.1010jiajiao.com/timu3_id_164298[举报]
方式一:一种含铜的矿石(硅孔雀石矿粉),含铜形态为CuCO3·Cu(OH)2和CuSiO3·2H2O(含有SiO2、FeCO3、Fe2O3、Al2O3等杂质)。以这种矿石为原料制取硫酸铜的工艺流程如下图:

请回答下列问题:
⑴完成步骤①中稀硫酸与CuSiO3·2H2O发生反应的化学方程式
CuSiO3·2H2O+H2SO4=CuSO4 +________+H2O;
⑵步骤②调节溶液pH选用的最佳试剂是__________________
A. CuO B. MgO C. FeCO3 D NH3·H2O
⑶有关氢氧化物开始沉淀和完全沉淀的pH如下表:
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 |
⑷滤液B通过蒸发浓缩(设体积浓缩为原来的一半)、冷却结晶可以得到CuSO4·5H2O晶体。某同学认为上述操作会伴有硫酸铝晶体的析出。请你结合相关数据对该同学的观点予以评价(已知常温下,Al2(SO4)3 饱和溶液中C(Al3+)=2.25mol·L-1,Ksp[Al(OH)3]=3.2×10-34) ________(填“正确”或“错误”)。
方式二:以黄铜矿精矿为原料,制取硫酸铜及金属铜的工艺如下所示:
Ⅰ.将黄铜矿精矿(主要成分为CuFeS2,含有少量CaO、MgO、Al2O3)粉碎
Ⅱ.采用如下装置进行电化学浸出实验,将精选黄铜矿粉加入电解槽阳极区,恒速搅拌,使矿粉溶解。在阴极区通入氧气,并加入少量催化剂。

Ⅲ.一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:
2RH(有机相)+ Cu2+(水相)
 R2Cu(有机相)+ 2H+(水相)
R2Cu(有机相)+ 2H+(水相)分离出有机相,向其中加入一定浓度的硫酸,使Cu2+得以再生。
Ⅳ.电解硫酸铜溶液制得金属铜。
(5)黄铜矿粉加入阳极区与硫酸及硫酸铁主要发生以下反应:
CuFeS2 + 4H+ = Cu2+ + Fe2+ + 2H2S 2Fe3+ + H2S = 2Fe2+ + S↓+ 2H+
电解过程中,阳极区Fe3+的浓度基本保持不变,原因是____________________(用电极反应式表示)。
(6)步骤Ⅲ,向有机相中加入一定浓度的硫酸,Cu2+得以再生的原理是_____________ 。
(7)步骤Ⅳ,若电解0.1mol CuSO4溶液,生成铜3.2 g,此时溶液中离子浓度由大到小的顺序是 ____ 。
(1)D在周期表中的位置为
(2)C与A形成的化合物中,既有极性键又有非极性键的化合物的化学式为
(3)写出E的气态氢化物与少量D的最高价氧化物的水化物反应的离子方程式
(4)在上述元素中,选择相同元素组成两种化合物X、Y.
①若混合X,Y的水溶液能发生反应,写出离子方程式
②若X呈碱性,在空气中久置会变成Y,写出X的化学式
若X呈酸性,在空气中久置会变成Y,写出X的名称
(5)DC与C2A反应的化学方程为
实验室里研究不同价态硫元素间的转化
1.二氧化硫(SO2)
(1)物理性质:通常情况下,二氧化硫________色,有________气味,比空气________,有________性,________溶于水.标准状况下,1体积水能溶解________体积二氧化硫.
(2)化学性质:二氧化硫中硫元素为+4价(中间价态),所以二氧化硫既有________又有________,二氧化硫是酸性氧化物,是________的酸酐.
①氧化性:SO2+2H2S![]() ________
________
②还原性:2SO2+O2![]() ________
________
SO2+Cl2+2H2O![]() ________
________
③酸性氧化物:与H2O、NaOH、Ca(OH)2等物质反应.
SO2+H2O![]() ________
________
④漂白性
可以使品红或其他有色物质褪色.原理是:二氧化硫能与某些有色物质化合生成不稳定的无色物质.这种无色物质受热或光照时易分解,放出SO2,恢复原来的颜色.
2.硫酸(H2SO4)
(1)物理性质:纯硫酸是________色、黏稠、________状液体,沸点________、难挥发.常用的浓硫酸质量分数是________,密度比水________.硫酸溶于水时放出大量的热.
②脱水性
浓硫酸能从一些有机物中将氢、氧两元素按H2O的组成(H∶O=2∶1)脱去.
例如:浓硫酸能使火柴棒、纸张变黑,就体现了其脱水性.
③强氧化性
Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
2H2SO4(浓)+C![]() ________.
________.
常温下,冷的浓H2SO4能使Fe和Al的表面形成一层________保护膜,阻止了内部金属与H2SO4反应.这种现象叫钝化.
总结:不同价态硫元素间的相互转化
0→-2:Fe+S![]() FeS,H2+S
FeS,H2+S![]() H2S……
H2S……
0→+4:S+O2![]() SO2,S+2H2SO4(浓)
SO2,S+2H2SO4(浓)![]() 3SO2↑+2H2O
3SO2↑+2H2O
0→+6:S+6HNO3(浓)![]() H2SO4+6NO2↑+2H2O
H2SO4+6NO2↑+2H2O
-20:2H2S+SO2![]() 2H2O+3S↓,H2S+Cl2
2H2O+3S↓,H2S+Cl2![]() 2HCl+S↓……
2HCl+S↓……
-2→+4:H2S+3H2SO4(浓)![]() 4SO2+4H2O
4SO2+4H2O
-2→+6:H2S+8HNO3(浓)![]() H2SO4+8NO2+4H2O
H2SO4+8NO2+4H2O
+4→0:2H2S+SO2![]() 2H2O+3S↓
2H2O+3S↓
+4→+6:2SO2+O2![]() ________……
________……
+6→+4:Cu+2H2SO4(浓)![]() ________
________
下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题: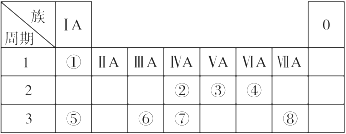
(1)在以上元素的原子中,原子半径最大的是 (填元素符号)。
(2)地壳中含量居于第二位的元素在周期表中的位置是 。
(3)①、④、⑤中的某些元素可形成既含离子键又含共价键的离子化合物,写出两种化合物的电子式 、 。
(4)W是第四周期与④同主族的元素。据此推测W不可能具有的性质是 。
| A.最高正化合价为+6价 | B.气态氢化物比H2S稳定 |
| C.最高价氧化物的水化物的酸性比硫酸弱 | D.单质在常温下可与氢气化合 |

X溶液与Y溶液反应的离子方程式 ,
M中阳离子的鉴定方法 。 查看习题详情和答案>>

(1)在以上元素的原子中,原子半径最大的是 (填元素符号)。
(2)地壳中含量居于第二位的元素在周期表中的位置是 。
(3)①、④、⑤中的某些元素可形成既含离子键又含共价键的离子化合物,写出两种化合物的电子式 、 。
(4)W是第四周期与④同主族的元素。据此推测W不可能具有的性质是 。
| A.最高正化合价为+6价 | B.气态氢化物比H2S稳定 |
| C.最高价氧化物的水化物的酸性比硫酸弱 | D.单质在常温下可与氢气化合 |

X溶液与Y溶液反应的离子方程式 ,
M中阳离子的鉴定方法 。