摘要:8.在某温度和压强下.30mLNO气体发生分解反应生成10mLNO2气体和10mLX气体.则X气体的分子式是( ) A .O2 B. N2 C.N2O D.N2O3
网址:http://m.1010jiajiao.com/timu3_id_163260[举报]
某有机物A是烃的含氧衍生物,为测定其组成有如下实验结果:
①在一定温度和压强下将A汽化,其质量是同温、同压下氢气质量的76倍;
②称取7.6g有机物A,在过量氧气中完全燃烧.将反应后的混合气体通过足量浓H2SO4后体积变为10.64L,浓硫酸增重3.6g.再将余下的气体通过盛有足量碱石灰的干燥管,气体体积减少至1.68L(气体体积均在标准状况下测定).
(1)确定A的分子式.
(2)若A物质遇FeCl3溶液无显色反应.试确定A的结构简式(写一种即可).
查看习题详情和答案>>
①在一定温度和压强下将A汽化,其质量是同温、同压下氢气质量的76倍;
②称取7.6g有机物A,在过量氧气中完全燃烧.将反应后的混合气体通过足量浓H2SO4后体积变为10.64L,浓硫酸增重3.6g.再将余下的气体通过盛有足量碱石灰的干燥管,气体体积减少至1.68L(气体体积均在标准状况下测定).
(1)确定A的分子式.
(2)若A物质遇FeCl3溶液无显色反应.试确定A的结构简式(写一种即可).
(1)在一定温度和压强下,5体积气体A2跟15体积的气体B2完全化合生成10体积某气体C,则该气体C的化学式为(用A、B表示)
(2)4gNaOH固体溶解后配制成100mL溶液,其物质的量浓度为
(3)
S2-微粒中的质子数是
查看习题详情和答案>>
AB3
AB3
.(2)4gNaOH固体溶解后配制成100mL溶液,其物质的量浓度为
1mol/L
1mol/L
,取出10mL该溶液,它的物质的量浓度为1mol/L
1mol/L
,将取出的10mL加水稀释至100mL,其物质的量浓度变为0.1mol/L
0.1mol/L
.(3)
34 16 |
16
16
,中子数是18
18
,核外电子数是18
18
.标准状况下11.2L的34SO2气体的质量是33个
33个
. I.在恒温条件下将一定量X和Y的混合气体通入一容积为2L的密闭容器中,
I.在恒温条件下将一定量X和Y的混合气体通入一容积为2L的密闭容器中,X和Y两物质的浓度随时间变化情况如图.
(1)该反应的化学方程式为(反应物或生成物用符号X、Y表示):
Y 2X
2X
 2X
2XY 2X
2X
. 2X
2X(2)a、b、c、d四个点中,表示化学反应处于平衡状态的点是
b、d
b、d
.II.如图是可逆反应X2+3Y2
 2Z2 在反应过程中的反应速率(?)与时间(t)的关系曲线,下列叙述正确的是
2Z2 在反应过程中的反应速率(?)与时间(t)的关系曲线,下列叙述正确的是B、D
B、D
.
A、t1时,只有正方向反应
B、t2时,反应到达限度
C、t2-t3,反应不再发生
D、t2-t3,各物质的浓度不再发生变化
III.以下是关于化学反应2SO2+O2
 2SO3 的两个素材:
2SO3 的两个素材:素材1:某温度和压强下,2升容器中,不同时间点测得密闭体系中三种物质的物质的量

素材2:在不同条件下进行时测得SO2的转化率:(SO2的转化率是反应的SO2占起始SO2的百分数)

从以上的两个素材中体会:
(1)根据素材1中计算20-30s期间,用二氧化硫表示的化学反应的平均速率为:
0.0075mol?L-1?s-1
0.0075mol?L-1?s-1
.(2)根据素材2中分析得到,提高该化学反应限度的途径有:
增大压强或在一定范围内降低温度
增大压强或在一定范围内降低温度
.(3)根据素材1、素材2中分析得到,要实现素材1中SO2的转化率需控制的反应条件是
温度为600℃,压强为1MPa
温度为600℃,压强为1MPa
.(1)
S2-微粒中的质子数是 ,中子数是 ,核外电子数是 .
(2)1.5mol CO2中含 mol碳原子, 个氧原子(以NA为阿伏加德罗常数的值),标准状况下的体积为 L.
(3)在一定温度和压强下,5体积气体A2跟15体积的气体B2完全化合生成10体积某气体C,则该气体C的化学式为(用A、B表示) .
查看习题详情和答案>>
34 16 |
(2)1.5mol CO2中含
(3)在一定温度和压强下,5体积气体A2跟15体积的气体B2完全化合生成10体积某气体C,则该气体C的化学式为(用A、B表示)
(2011?咸阳模拟)如图是工业生产硝酸铵的流程示意图.
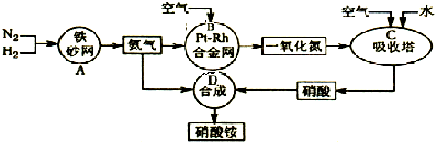
(1)吸收塔C中通入过量空气的目的是
(2)已知:4NH3(g)+3O2(g)═2N2(g)+6H2O(g),△H=-1266.8kJ/mol;
N2(g)+O2(g)═2NO(g),△H=+180.5kJ/mol
据此写出氨高温催化氧化的热化学方程式:
若上述催化氧化过程转移了5mol电子,则反应的能量变化为
(3)在化工研究中,经常要判断反应能否自发进行,若某反应的△H<0,则该反应是否一定能自发进行?
(4)已知:N2(g)+3H2(g)?2NH3(g),△H=-92kJ/mol.为提高氢气的转化率,宜采取的措施有
A.适当升高温度
B.使用更有效的催化剂
C.增大压强
D.循环利用和不断补充氮气
E.及时分离出氨气
(5)在一定温度和压强下,将H2和N2按3:1的体积比在密闭容器中混合,当反应达到平衡时,测得平衡混合气中NH3的体积分数为20.0%,此时H2的转化率为
查看习题详情和答案>>

(1)吸收塔C中通入过量空气的目的是
使NO充分氧化(或者“提高NO的转化率”)
使NO充分氧化(或者“提高NO的转化率”)
.A、B、C、D四个容器中的反应,属于氧化还原反应的是ABC
ABC
(填字母).(2)已知:4NH3(g)+3O2(g)═2N2(g)+6H2O(g),△H=-1266.8kJ/mol;
N2(g)+O2(g)═2NO(g),△H=+180.5kJ/mol
据此写出氨高温催化氧化的热化学方程式:
4NH3(g)+5O2(g)=4NO(g)+6H2O(g),△H=-905.8KJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(g),△H=-905.8KJ/mol
.若上述催化氧化过程转移了5mol电子,则反应的能量变化为
226.45
226.45
kJ.(3)在化工研究中,经常要判断反应能否自发进行,若某反应的△H<0,则该反应是否一定能自发进行?
不一定
不一定
(填“一定”或“不一定”)(4)已知:N2(g)+3H2(g)?2NH3(g),△H=-92kJ/mol.为提高氢气的转化率,宜采取的措施有
CDE
CDE
(填字母).A.适当升高温度
B.使用更有效的催化剂
C.增大压强
D.循环利用和不断补充氮气
E.及时分离出氨气
(5)在一定温度和压强下,将H2和N2按3:1的体积比在密闭容器中混合,当反应达到平衡时,测得平衡混合气中NH3的体积分数为20.0%,此时H2的转化率为
33.3%
33.3%
(计算结果保留一位小数).