题目内容
 I.在恒温条件下将一定量X和Y的混合气体通入一容积为2L的密闭容器中,
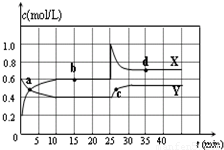
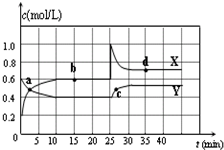
I.在恒温条件下将一定量X和Y的混合气体通入一容积为2L的密闭容器中,X和Y两物质的浓度随时间变化情况如图.
(1)该反应的化学方程式为(反应物或生成物用符号X、Y表示):
Y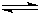 2X
2X
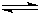 2X
2XY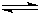 2X
2X
.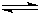 2X
2X(2)a、b、c、d四个点中,表示化学反应处于平衡状态的点是
b、d
b、d
.II.如图是可逆反应X2+3Y2
 2Z2 在反应过程中的反应速率(?)与时间(t)的关系曲线,下列叙述正确的是
2Z2 在反应过程中的反应速率(?)与时间(t)的关系曲线,下列叙述正确的是B、D
B、D
.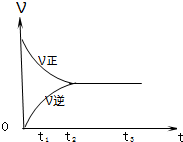
A、t1时,只有正方向反应
B、t2时,反应到达限度
C、t2-t3,反应不再发生
D、t2-t3,各物质的浓度不再发生变化
III.以下是关于化学反应2SO2+O2
 2SO3 的两个素材:
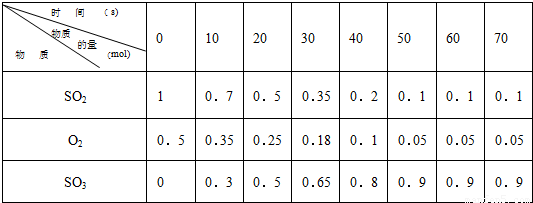
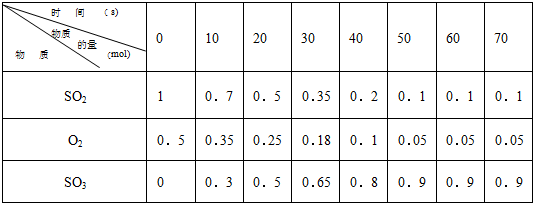
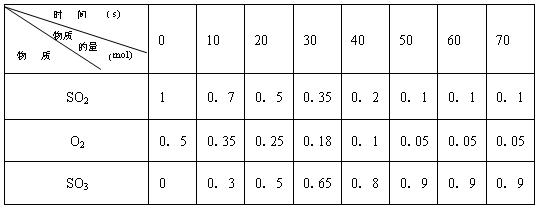
2SO3 的两个素材:素材1:某温度和压强下,2升容器中,不同时间点测得密闭体系中三种物质的物质的量
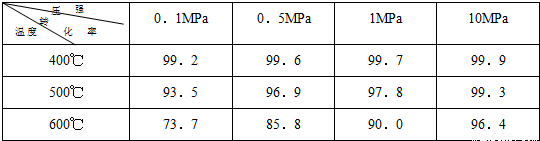
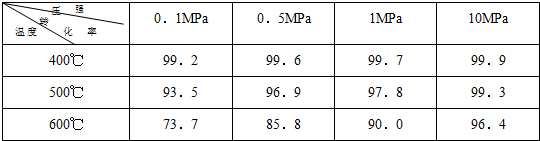
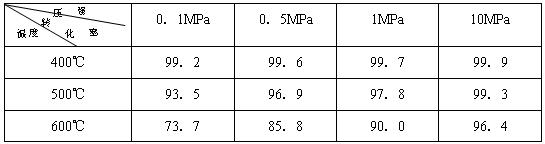
素材2:在不同条件下进行时测得SO2的转化率:(SO2的转化率是反应的SO2占起始SO2的百分数)
从以上的两个素材中体会:
(1)根据素材1中计算20-30s期间,用二氧化硫表示的化学反应的平均速率为:
0.0075mol?L-1?s-1
0.0075mol?L-1?s-1
.(2)根据素材2中分析得到,提高该化学反应限度的途径有:
增大压强或在一定范围内降低温度
增大压强或在一定范围内降低温度
.(3)根据素材1、素材2中分析得到,要实现素材1中SO2的转化率需控制的反应条件是
温度为600℃,压强为1MPa
温度为600℃,压强为1MPa
.分析:I.(1)根据浓度的变化量确定反应速率的关系,利用反应速率之比等于化学计量数之比来书写反应方程式;
(2)根据图象及物质的浓度不发生变化时表示化学反应处于平衡状态;
II.由图可知,反应从正反应开始,在t2之前正反应速率大于逆反应速率,t2时反应到达限度,在t2之后化学反应处于动态平衡中,各物质的浓度不再变化;
III.(1)根据20-30s内二氧化硫的物质的量的变化及v=
来计算;
(2)根据素材2可知,压强越大、温度越低时有利于提高该化学反应限度;
(3)根据素材1计算二氧化硫的转化率,利用素材2来确定合适的温度、压强.
(2)根据图象及物质的浓度不发生变化时表示化学反应处于平衡状态;
II.由图可知,反应从正反应开始,在t2之前正反应速率大于逆反应速率,t2时反应到达限度,在t2之后化学反应处于动态平衡中,各物质的浓度不再变化;
III.(1)根据20-30s内二氧化硫的物质的量的变化及v=
| △c |
| △t |
(2)根据素材2可知,压强越大、温度越低时有利于提高该化学反应限度;
(3)根据素材1计算二氧化硫的转化率,利用素材2来确定合适的温度、压强.
解答:解:I.(1)由图可知,X的物质的量增加,Y的物质的量减少,则X为生成物,Y为反应物,
再由10mim达到平衡可知,
=
=1:2,
根据反应速率之比等于化学计量数之比,则反应为Y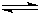 2X,
2X,
故答案为:Y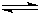 2X;
2X;
(2)由图可知,10-25min及35min之后X、Y的物质的量不发生变化,则相应时间段内的点处于化学平衡状态,
即b、d处于化学平衡状态,故答案为:b、d;
II.A、t1时,正逆反应都发生,且正方向反应速率大于逆反应速率,故A错误;
B、t2时,正逆反应速率相等,则反应到达限度,故B正确;
C、t2-t3,正逆反应速率相等,化学反应达到动态平衡,故C错误;
D、t2-t3,为化学平衡状态,各物质的浓度不再发生变化,故D正确;
故答案为:B、D;
III.(1)由素材1可知,20-30s内二氧化硫的物质的量的变化量为0.5mol-0.35mol=0.15mol,
则二氧化硫表示的化学反应的平均速率为
=0.0075 mol?L-1?s-1,
故答案为:0.0075 mol?L-1?s-1;
(2)由素材2可知,压强越大、温度越低时有利于提高该化学反应限度,但温度太低时反应速率较慢,
故答案为;增大压强或在一定范围内降低温度;
(3)由素材1可知,50s时反应达到平衡,则二氧化硫的转化率为
=90%,
结合素材2可知,转化率为90%时温度为600℃,压强为1MPa,
故答案为:温度为600℃,压强为1MPa.
再由10mim达到平衡可知,
| △n(Y) |
| △n(X) |
| 0.6-0.4 |
| 0.6-0.2 |
根据反应速率之比等于化学计量数之比,则反应为Y
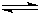 2X,
2X,故答案为:Y
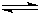 2X;
2X; (2)由图可知,10-25min及35min之后X、Y的物质的量不发生变化,则相应时间段内的点处于化学平衡状态,
即b、d处于化学平衡状态,故答案为:b、d;
II.A、t1时,正逆反应都发生,且正方向反应速率大于逆反应速率,故A错误;
B、t2时,正逆反应速率相等,则反应到达限度,故B正确;
C、t2-t3,正逆反应速率相等,化学反应达到动态平衡,故C错误;
D、t2-t3,为化学平衡状态,各物质的浓度不再发生变化,故D正确;
故答案为:B、D;
III.(1)由素材1可知,20-30s内二氧化硫的物质的量的变化量为0.5mol-0.35mol=0.15mol,
则二氧化硫表示的化学反应的平均速率为
| ||
| 10s |
故答案为:0.0075 mol?L-1?s-1;
(2)由素材2可知,压强越大、温度越低时有利于提高该化学反应限度,但温度太低时反应速率较慢,
故答案为;增大压强或在一定范围内降低温度;
(3)由素材1可知,50s时反应达到平衡,则二氧化硫的转化率为
| 1mol-0.1mol |
| 1mol |
结合素材2可知,转化率为90%时温度为600℃,压强为1MPa,
故答案为:温度为600℃,压强为1MPa.
点评:本题考查化学反应速率及化学平衡图象,注重对图象的分析,明确图象中纵横坐标及点、线、面的意义是解答本题的关键,难度不大.

练习册系列答案
相关题目
某兴趣小组为探究外界条件对可逆反应 A(g)+B(g)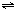 C(g)+D(s)的影响,在恒温条件下往一个容积为10L的密闭容器中充入1molA和1molB,反应达平衡时测得容器中各物质的浓度为I然后每次改变一种反应条件做了另三组实验,重新达到平衡时容器中各成分的浓度(其中D用物质的量来表达)分别为Ⅱ.Ⅲ.Ⅳ. C(g)+D(s)的影响,在恒温条件下往一个容积为10L的密闭容器中充入1molA和1molB,反应达平衡时测得容器中各物质的浓度为I然后每次改变一种反应条件做了另三组实验,重新达到平衡时容器中各成分的浓度(其中D用物质的量来表达)分别为Ⅱ.Ⅲ.Ⅳ.
|
 C(g)+D(s)的影响,在恒温条件下往一个容积为10L的密闭容器中充入1mol A和1mol B,反应达平衡时测得容器中各物质的浓度为I然后每次改变一种反应条件做了另三组实验,重新达到平衡时容器中各成分的浓度(其中D用物质的量来表达)分别为Ⅱ.Ⅲ.Ⅳ.
C(g)+D(s)的影响,在恒温条件下往一个容积为10L的密闭容器中充入1mol A和1mol B,反应达平衡时测得容器中各物质的浓度为I然后每次改变一种反应条件做了另三组实验,重新达到平衡时容器中各成分的浓度(其中D用物质的量来表达)分别为Ⅱ.Ⅲ.Ⅳ.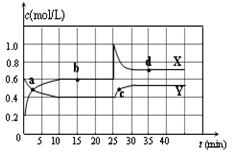

 2Z2 在反应过程中的反应速率(?)与时间(t)的关系曲线,下列叙述正确的是______.
2Z2 在反应过程中的反应速率(?)与时间(t)的关系曲线,下列叙述正确的是______.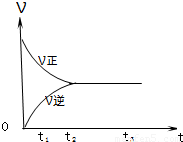
 2SO3 的两个素材:
2SO3 的两个素材: