网址:http://m.1010jiajiao.com/timu3_id_162969[举报]
(12分)高锰酸钾是深紫色的针状晶体,是最重要也是最常用的氧化剂之一,可用来漂白棉、毛、丝等纺织品。已知温度高于80℃高锰酸钾会部分分解
实验室以软锰矿(主要成份是MnO2)为主要原料来制备高锰酸钾,分两步进行:
第一步是将+4价的锰氧化成为+6价,反应方程式为:
![]()
第二步是在通入CO2条件下使+6价的锰歧化为+7价和+4价(MnO2)。
实验流程如下: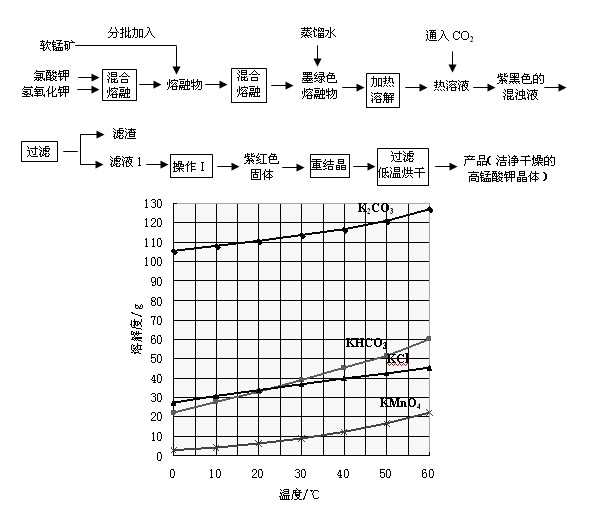
几种物质的溶解度随温度变化如上图所示。回答下列问题:
(1)下列仪器中,混合熔融氯酸钾和氢氧化钾固体过程中需要用到的是
A.蒸发皿 B.玻璃棒 C.铁棒 D.坩埚 E.泥三角 F.烧杯 G.酒精灯 H.铁坩埚
![]()
(2)通入适量二氧化碳,锰酸钾发生岐化反应的化学方程式是
![]()
(3)通入适量的二氧化碳直到锰酸钾全部岐化为止(可用玻璃棒蘸取溶液点于滤纸上,如果滤纸上只有紫红色而无绿色
痕迹,即表示锰酸钾已歧化完全),二氧化碳的通入量不能过多的原因是 。
![]()
(4)操作Ⅰ应该在 (填“加压”、“减压”、“常压”)情况下蒸发,其理由是 。(5)除了酸化可以使锰酸钾发生岐化反应生成高锰酸钾外(歧化法),通过使用惰性电极电解锰酸钾溶液也可以制备高锰酸钾。电解时阴极有气泡产生,则阳极的电极反为 。
与歧化法相比,电解法主要的优点是 。
查看习题详情和答案>> 为测定Na3CO3与Na2SO3混合物中各组分的含量,取样品23.2g,用下图所示装置进行实验(铁架台、铁夹等仪器未在图中画出):
为测定Na3CO3与Na2SO3混合物中各组分的含量,取样品23.2g,用下图所示装置进行实验(铁架台、铁夹等仪器未在图中画出):(1)将仪器连接好以后,必须进行的第一步操作是:
(2)此实验还必须用到的最重要的仪器是
(3)若实验室中各有以下常用试剂:a.浓硫酸; b.品红溶液;c.酸性高锰酸钾溶液;d.饱和碳酸氢钠溶液;e.氢氧化钠溶液:f.无水硫酸铜;g.碱石灰;h.五氧化二磷;i.无水氯化钙.那么在B、D装置应该分别盛放的试剂是(填序号):B
已知装置c中装有品红溶液,但有人认为在c中若装品红溶液可能引起Na2S03含量的测量结果比实际值偏高,理由是
(4)实验过程中,当仪器A内的固体反应完全后,需打开活塞K,向A中缓慢通入大量的空气.
这样做的目的是
(5)若装置E在实验完成时增重4.4g,则Na2CO3与Na2SO3的物质的量之比为

(1)将仪器连接好以后,必须进行的第一步操作是
(2)此实验还必须用到的最重要的仪器是
(3)实验室中备有以下常用试剂:
a.浓硫酸 b.品红溶液 c.酸性高锰酸钾溶液 d.饱和碳酸氢钠溶液 e.氢氧化钠溶液
f.无水硫酸铜 g.碱石灰 h.五氧化二磷 i.无水氯化钙
请将下列容器中应盛放的试剂序号填入相应空格:B中
(4)实验过程中,当仪器A内的固体反应完全后,需打开活塞K,向A中通入大量的空气.这样做的目的是
所通空气应先经过
(5)若要提高实验的准确性,还应在

(1)将仪器连接好以后,必须进行的第一步操作是________________。
(2)此实验还必须用到的最重要的仪器是_______________;仪器F的作用是______________。
(3)已知仪器C中装有品红溶液,其作用是______________,有人提出该溶液可能引起Na2CO3含量的测量结果比实际值偏低,理由是________________。
(4)实验室中备有以下常用试剂:a.浓硫酸 b.品红溶液 c.酸性高锰酸钾溶液 d.氢氧化钠溶液 e.无水硫酸铜 f.碱石灰 g.五氧化二磷 h.无水氯化钙
请将下列容器中应盛放的试剂序号填入相应空格:
B中_______________,D中__________________,E中__________________。
实验过程中,当仪器A内的固体反应完全后,需打开活塞K,向A中通入大量的空气。这样做的目的是使A、B、C、D各仪器中残留的CO2进入E被充分吸收。所通空气应先经过________试剂(填上述所供试剂的序号)处理,否则可能引起Na2SO3含量的测量结果比实际值________(填“偏高”“偏低”或“没影响”)。
(5)若仪器E在实验完成时增重
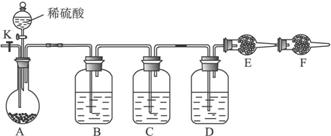
(1)将仪器连接好以后,必须进行的第一步操作是_______________________。
(2)此实验还必须用到的最重要的仪器是_________;仪器F的作用是________________。
(3)已知仪器C中装有品红溶液,其作用是______________,有人提出该溶液可能引起Na2CO3含量的测量结果比实际值偏低,理由是______________________________________。
(4)实验室中备有以下常用试剂:a.浓硫酸 b.品红溶液 c.酸性高锰酸钾溶液 d.氢氧化钠溶液 e.无水硫酸铜 f.碱石灰 g.五氧化二磷 h.无水氯化钙
请将下列容器中应盛放的试剂序号填入相应空格:
B中____________,D中__________,E中__________。
实验过程中,当仪器A内的固体反应完全后,需打开活塞K,向A中通入大量的空气。这样做的目的是使A、B、C、D各仪器中残留的CO2进入E被充分吸收。所通空气应先经过试剂_____________(填上述所供试剂的序号)处理,否则可能引起Na2SO3含量的测量结果比实际值__________(填“偏高”“偏低”或“没影响”)。
(5)若仪器E在实验完成时增重