摘要:0.2mol Na2SO4与0.2 mol Na2S中.所含( )相等. 硫离子 氧原子
网址:http://m.1010jiajiao.com/timu3_id_162859[举报]
一定温度下,在体积为2L的密闭容器中加入1molX和1molY进行如下反应:X(g)+Y(g)?2Z(g)+W(s)△H>0,当反应进行到2min时达到平衡,测知Z的浓度为0.2mol?L-1.下列判断正确的是( )
查看习题详情和答案>>
I、超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层.科学家正在研究利用催化技术处理尾气,化学方程式为2NO+2CO
2CO2+N2,为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如下表:
请回答(均不考虑温度变化对催化效率的影响):
(1)若上述反应的平衡常数K,随温度增高而减小,则反应的△H 0(填“>”、“<”或“=”).
(2)前2s内的平均反应速度v(N2)= .
(3)该温度下,反应的平衡常数K= .
II、甲醇空气燃料电池(酸性电解质溶液)的工作原理如图一所示.
(1)该电池正极的电极反应式为 .
(2)以上述电池为电源,构成图二电解池,其中X、Y为石墨,a为KCl溶液,写出电解总反应的离子方程式 .
(3)常温时,按“(2)”电解一段时间后,取25mL上述电解后的溶液,滴加0.2mol/L的醋酸溶液,滴加过程的pH变化如图三所示,则C点对应溶液中各离子浓度的大小关系为(忽略电解后溶液中的其他成分,只考虑其中的碱与加入的酸) .
查看习题详情和答案>>
| 催化剂 |
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol?L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/mol?L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
(1)若上述反应的平衡常数K,随温度增高而减小,则反应的△H
(2)前2s内的平均反应速度v(N2)=
(3)该温度下,反应的平衡常数K=
II、甲醇空气燃料电池(酸性电解质溶液)的工作原理如图一所示.

(1)该电池正极的电极反应式为
(2)以上述电池为电源,构成图二电解池,其中X、Y为石墨,a为KCl溶液,写出电解总反应的离子方程式
(3)常温时,按“(2)”电解一段时间后,取25mL上述电解后的溶液,滴加0.2mol/L的醋酸溶液,滴加过程的pH变化如图三所示,则C点对应溶液中各离子浓度的大小关系为(忽略电解后溶液中的其他成分,只考虑其中的碱与加入的酸)
(1)按要求写出下列反应的离子方程式
硫酸溶液中滴加氢氧化钡溶液
(2)新制的氯水中存在Cl2、H2O、HClO、H+、Cl-、ClO-等,其中能起杀菌消毒作用的是 ;能参与Zn反应生成氢气的是 ;能与硝酸和硝酸银的混合液作用生成白色沉淀的是 ;能使染料和有机色质褪色的是 .用滴管将新制的饱和氯水缓缓滴入预先滴有酚酞试液的NaOH溶液中,当滴到一定量时红色完全褪去.产生这种现象的原因可能有两种:a是 ;b是 .
(3)①质量都是50g的HCl、NH3、CO2、O2四种气体中,含有分子数目最少的是 ,在相同温度和相同压强条件下,体积最大的是 ,密度最小的是 .
②在 mL 0.2mol?L-1 NaOH溶液中含1g溶质;配制50mL 0.2mol?L-1 CuSO4溶液,需要CuSO4?5H2O g.
(4)在2KMnO4+16HBr═5Br2+2MnBr2+2KBr+8H2O反应中,氧化剂是 ,还原剂是 ,耗1mol氧化剂,则被氧化的还原剂的物质的量是 mol.
查看习题详情和答案>>
硫酸溶液中滴加氢氧化钡溶液
(2)新制的氯水中存在Cl2、H2O、HClO、H+、Cl-、ClO-等,其中能起杀菌消毒作用的是
(3)①质量都是50g的HCl、NH3、CO2、O2四种气体中,含有分子数目最少的是
②在
(4)在2KMnO4+16HBr═5Br2+2MnBr2+2KBr+8H2O反应中,氧化剂是
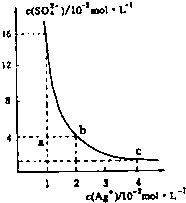 某温度时,Ag2SO4在水溶液中的沉淀溶解平衡曲线如图所示,下列说法中不正确的是( )
某温度时,Ag2SO4在水溶液中的沉淀溶解平衡曲线如图所示,下列说法中不正确的是( )