题目内容
一定温度下,在体积为2L的密闭容器中加入1molX和1molY进行如下反应:X(g)+Y(g)?2Z(g)+W(s)△H>0,当反应进行到2min时达到平衡,测知Z的浓度为0.2mol?L-1.下列判断正确的是( )
分析:A.W为纯固体,改变用量对反应速率无影响;
B.加X,平衡正向移动,吸收热量变大,但反应热不变;
C.温度不变,将容器的体积扩大一倍,平衡不移动;
D.利用反应速率之比等于化学计量数之比分析.
B.加X,平衡正向移动,吸收热量变大,但反应热不变;
C.温度不变,将容器的体积扩大一倍,平衡不移动;
D.利用反应速率之比等于化学计量数之比分析.
解答:解:A.W为纯固体,改变用量对反应速率无影响,正逆反应速率不变,故A错误;
B.加X,平衡正向移动,吸收热量变大,但反应热不变,即反应的△H不变,故B错误;
C.该反应为气体体积不变的反应,温度不变,将容器的体积扩大一倍,平衡不移动,则Z的平衡浓度变为原来的1/2,故C正确;
D.2min时达到平衡,测知Z的浓度为0.2mol?L-1,v(Z)=0.1mol/(L.min),由反应速率之比等于化学计量数之比可知,用Y表示的反应速率为0.05mol?L-1?min-1,故D错误;
故选C.
B.加X,平衡正向移动,吸收热量变大,但反应热不变,即反应的△H不变,故B错误;
C.该反应为气体体积不变的反应,温度不变,将容器的体积扩大一倍,平衡不移动,则Z的平衡浓度变为原来的1/2,故C正确;
D.2min时达到平衡,测知Z的浓度为0.2mol?L-1,v(Z)=0.1mol/(L.min),由反应速率之比等于化学计量数之比可知,用Y表示的反应速率为0.05mol?L-1?min-1,故D错误;
故选C.
点评:本题考查影响反应速率的因素和化学平衡移动,为高考常考考点,注意B、C为解答的易错点,把握反应方程式的特点是解答的关键,题目难度不大.

练习册系列答案
 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案
相关题目

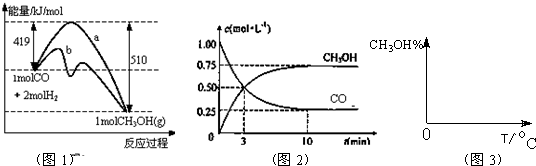
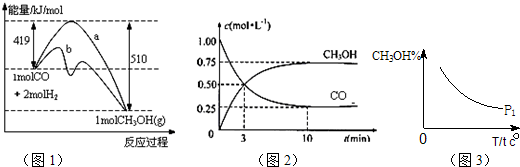
 CH3OH(g).图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化.
CH3OH(g).图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化.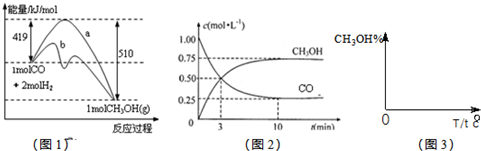
 CH3OH(g)的平衡常数为
CH3OH(g)的平衡常数为