摘要:将16g氧化铜强热.部分分解为Cu2O.称得剩余的固体物质的质量为15.2g.则该剩余固体物质中CuO和Cu2O物质的量之比是( ) 2:1 (D)1:2
网址:http://m.1010jiajiao.com/timu3_id_162825[举报]
将16g氧化铜强热,部分分解为氧化亚铜和氧气,称得剩余的固体物质的质量为15.2g,则该剩余固体物质中CuO和![]() 的物质的量之比是
的物质的量之比是
[ ]
|
A.1∶1 |
B.3∶1 |
|
C.2∶1 |
D.1∶2 |
将硫酸亚铁晶体(FeSO4·7H2O)放入图Ⅰ 的干燥试管A里隔绝空气加强热,充分反应后,试管A里残留固体甲,试管B内得到无色液体乙。取出甲放在图Ⅱ的石英管C中部,连接好其他部分的仪器后,开启旋塞K,逐滴滴下乙醇使C管左部石棉绒(一种纤维状硅酸盐材料,很稳定,不燃烧)浸润吸足,关闭K。然后加热5分钟左右,加热过程中还较快地开启或关闭旋塞K以补充乙醇并使之渗入石棉绒里,同时观察到甲的颜色由红棕色逐渐变为黑色。反应停止后,取试管E中的液体0.5 mL逐渐加入到图Ⅲ盛有新配制的银氨溶液的试管F里,水浴加热,不久观察到试管内壁出现光亮如镜的物质。回答下列问题:?
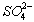
(1)写出图Ⅰ干燥试管里隔绝空气强热硫酸亚铁晶体的化学方程式:?
。?
(2)根据反应原理请你评价图 Ⅰ 实验装置的主要缺点是什么??
。?
(3)试管B中所得液体乙的名称是 ;如何用实验确证乙的阴离子? 。?
(4)怎样检验图Ⅱ装置的气密性? 。
(5)管D在此处的主要作用是 。
(6)根据图Ⅲ试管F中的现象得出的结论是 ;写出C管中发生反应的化学方程式___ 。?
查看习题详情和答案>>
有三种不同质量比的氧化铜与炭粉的混合物样品①②③。甲、乙、丙三同学各取一种样品,加强热充分反应,测定各样品中氧化铜的量。
(1)甲取样品①强热,若所得固体为金属铜,将其置于足量的稀硝酸中微热,产生?1.12 L?(标准状况)气体,则样品①中氧化铜的质量为___________g。
(2)乙取样品②a g强热,生成的气体不能使澄清的石灰水变浑浊。再将反应后的固体与足量的稀硝酸微热,充分反应后,有b g固体剩余,该剩余固体的化学式为____________________。样品②中氧化铜质量为__________g(以含a、b的代数式表示)。
(3)丙称量样品③强热后剩余的固体,质量比原样品减少了c g,若该固体为金属铜,则样品③中氧化铜物质的量(n)的取值范围为__________。
查看习题详情和答案>>