摘要: 经实验测得某一溶液由Mg2+.Al3+.Cl-.SO42-四种离子组成.其中Al3+.SO42-.Cl-个数比为3:1:13.则推出该溶液中Mg2+.Al3+.SO42-离子的个数比为
网址:http://m.1010jiajiao.com/timu3_id_162736[举报]
如何防止铁的锈蚀是工业上研究的重点内容.为研究铁锈蚀的影响因素,某同学做了如下探究实验:
请回答:
(1)上述实验中发生了电化学腐蚀的是(填实验序号) .
(2)由该实验可知,可以影响铁锈蚀速率的因素是 .
(3)为防止铁的锈蚀,工业上普遍采用的方法是 (答两种方法).
(4)已知铁丝样品质量为3.5g,经实验测得未锈蚀铁的质量分数为80%.则未锈蚀铁与足量稀硫酸反应生成氢气的体积为 (标准状况).
查看习题详情和答案>>
| 序号 | 内容 | 实验现象 |
| 1 | 常温下将铁丝放在干燥空气中一个月 | 干燥的铁丝表面依然光亮 |
| 2 | 常温下将铁丝放在潮湿空气中一小时 | 铁丝表面依然光亮 |
| 3 | 常温下将铁丝放在潮湿的空气中一个月 | 铁丝表面已变得灰暗 |
| 4 | 将潮湿的铁丝放在常温的氧气流中一小时 | 铁丝表面略显灰暗 |
| 5 | 将潮湿的铁丝放在高于常温的氧气流中一小时 | 铁丝表面已变得灰暗 |
| 6 | 将浸过氯化钠溶液的铁丝放在高于常温的氧气流中一小时 | 铁丝表面灰暗程度比实验5严重 |
(1)上述实验中发生了电化学腐蚀的是(填实验序号)
(2)由该实验可知,可以影响铁锈蚀速率的因素是
(3)为防止铁的锈蚀,工业上普遍采用的方法是
(4)已知铁丝样品质量为3.5g,经实验测得未锈蚀铁的质量分数为80%.则未锈蚀铁与足量稀硫酸反应生成氢气的体积为
以法拉第为代表的科学家从煤焦油中分离出了以芳香烃为主的多种重要芳香族化合物,其中最简单的芳香烃是苯.
(1)苯环结构中,不存在单双键交替结构,可以作为证据的事实是
①苯不能使KMnO4(H+)溶液褪色
②苯分子中碳原子之间的距离均相等
③苯能在一定条件下跟H2加成生成环己烷
④经实验测得邻二甲苯仅有一种结构
⑤苯在FeBr3存在的条件下同液溴可以发生取代反应,但不因化学变化而使溴水褪色
⑥经实验测得对二溴苯仅有一种结构
(2)某芳香烃的结构简式如图:
该烃中含有四面体结构的碳原子数为
酸钾氧化后含苯环的产物是(写结构简式)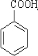
 .
.
查看习题详情和答案>>
(1)苯环结构中,不存在单双键交替结构,可以作为证据的事实是
①②④⑤
①②④⑤
①苯不能使KMnO4(H+)溶液褪色
②苯分子中碳原子之间的距离均相等
③苯能在一定条件下跟H2加成生成环己烷
④经实验测得邻二甲苯仅有一种结构
⑤苯在FeBr3存在的条件下同液溴可以发生取代反应,但不因化学变化而使溴水褪色
⑥经实验测得对二溴苯仅有一种结构
(2)某芳香烃的结构简式如图:

该烃中含有四面体结构的碳原子数为
2
2
,可能在同一平面的碳原子数最多为10
10
,该烃被酸性高锰酸钾氧化后含苯环的产物是(写结构简式)


用数轴表示化学知识,并按某种共性对化学物质进行分类,有简明易记的效果.例如,根据碳素钢的含碳量,将其分为低碳钢、中碳钢和高碳钢,利用数轴的分类法可将其表示为
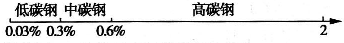
根据这一分类法回答下列问题:
(1)将pH与溶液酸碱性的关系粗略地表示在如下数轴上(常温下):
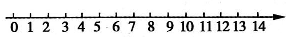
(2)某化学兴趣小组欲研究H2SO4、KCl、Na2SO3、Na2CO3、NaCl、NaOH的性质,对于如何研究,他们设计了两种方案:
方案Ⅰ:将它们按照酸、碱、盐分类,然后分别溶于水得到溶液,进行实验.
方案Ⅱ:将它们按照钠盐、钾盐和其他化合物分类,然后分别溶于水得到溶液,边行实验.
①根据方案Ⅰ进行分类时,经实验测得KCl、NaCl溶液的pH等于7;H2SO4溶液的pH小于7;Na2SO3、Na2CO3、NaOH溶液的pH大于7.由此有的同学按分类法思想把Na2SO3、Na2CO3与NaOH都划分为碱类,这样划分是否合理?为什么?
②在方案Ⅰ中,某同学发现盐类物质中的KCl和NaCl两种物质,它们在与其他物质混合时现象相同,无法区分,请你设计一种简单的方法区分这两种物质:
③在方案Ⅱ中,三种钠盐用其他化合物中的
④该兴趣小组中的一位同学认为,还可以根据是否含有钠元素将上述六种物质分为Na2SO3、Na2CO3、NaCl、NaOH和H2SO4、KCl两类.在用H2SO4鉴别四种含钠元素的物质时,Na2SO3和Na2CO3,很容易区分,但鉴别NaCl和NaOH时却陷入了困境,请你帮忙解决这一难题(试剂只限于上述六种物质):
查看习题详情和答案>>
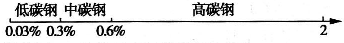
根据这一分类法回答下列问题:
(1)将pH与溶液酸碱性的关系粗略地表示在如下数轴上(常温下):
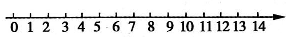
(2)某化学兴趣小组欲研究H2SO4、KCl、Na2SO3、Na2CO3、NaCl、NaOH的性质,对于如何研究,他们设计了两种方案:
方案Ⅰ:将它们按照酸、碱、盐分类,然后分别溶于水得到溶液,进行实验.
方案Ⅱ:将它们按照钠盐、钾盐和其他化合物分类,然后分别溶于水得到溶液,边行实验.
①根据方案Ⅰ进行分类时,经实验测得KCl、NaCl溶液的pH等于7;H2SO4溶液的pH小于7;Na2SO3、Na2CO3、NaOH溶液的pH大于7.由此有的同学按分类法思想把Na2SO3、Na2CO3与NaOH都划分为碱类,这样划分是否合理?为什么?
②在方案Ⅰ中,某同学发现盐类物质中的KCl和NaCl两种物质,它们在与其他物质混合时现象相同,无法区分,请你设计一种简单的方法区分这两种物质:
焰色反应透过钴玻璃呈紫色说明是氯化钾,焰色反应呈黄色为氯化钠
焰色反应透过钴玻璃呈紫色说明是氯化钾,焰色反应呈黄色为氯化钠
.③在方案Ⅱ中,三种钠盐用其他化合物中的
H2SO4
H2SO4
可加以区分,有关反应的化学方程式分别为H2SO4+Na2CO3=Na2SO4+CO2↑+H2O H2SO4+Na2SO3=Na2SO4+SO2↑+H2O
H2SO4+Na2CO3=Na2SO4+CO2↑+H2O H2SO4+Na2SO3=Na2SO4+SO2↑+H2O
.④该兴趣小组中的一位同学认为,还可以根据是否含有钠元素将上述六种物质分为Na2SO3、Na2CO3、NaCl、NaOH和H2SO4、KCl两类.在用H2SO4鉴别四种含钠元素的物质时,Na2SO3和Na2CO3,很容易区分,但鉴别NaCl和NaOH时却陷入了困境,请你帮忙解决这一难题(试剂只限于上述六种物质):
在两支试管中分别加入少许硫酸溶液,分别加入稍过量的两种未知溶液,充分混合,再向混合液中分别滴入碳酸钠溶液,若有气泡生成,则加入的未知液为NaCl,若无气泡生成,则加入的未知液为NaOH溶液;
在两支试管中分别加入少许硫酸溶液,分别加入稍过量的两种未知溶液,充分混合,再向混合液中分别滴入碳酸钠溶液,若有气泡生成,则加入的未知液为NaCl,若无气泡生成,则加入的未知液为NaOH溶液;
.
全世界每年因钢铁锈蚀造成大量的损失.某学生欲探究在蒸馏水、氯化钠溶液和醋酸溶液三种条件下铁锈蚀的快慢,设计了如下实验.
请回答:
(1)在一周的观察过程中,他发现实验序号为 的试管中铁钉锈蚀速度最慢.
(2)实验②中发生的是 (填“电化学腐蚀”或“化学腐蚀”).
(3)下列防止钢铁锈蚀的措施合理的是 (填字母).
a.在自行车的钢圈表面镀镍
b.在地下钢铁管道上连接铜块
c.改变金属内部结构制成不锈钢
(4)已知铁钉样品质量为4.00g,经实验测得未锈蚀铁的质量分数为70%.则未锈蚀铁与足量稀硫酸反应生成氢气的体积为 (标准状况).
查看习题详情和答案>>
| 实验序号 | ① | ② | ③ |
| 实验 内容 |
 |
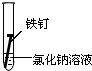 |
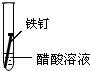 |
(1)在一周的观察过程中,他发现实验序号为
(2)实验②中发生的是
(3)下列防止钢铁锈蚀的措施合理的是
a.在自行车的钢圈表面镀镍
b.在地下钢铁管道上连接铜块
c.改变金属内部结构制成不锈钢
(4)已知铁钉样品质量为4.00g,经实验测得未锈蚀铁的质量分数为70%.则未锈蚀铁与足量稀硫酸反应生成氢气的体积为
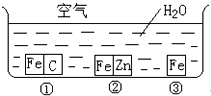 如何防止铁的锈蚀是工业上研究的重点内容.为研究铁的锈蚀,某同学做了探究实验,如图所示,铁处于①、②、③三种不同的环境中.请回答:
如何防止铁的锈蚀是工业上研究的重点内容.为研究铁的锈蚀,某同学做了探究实验,如图所示,铁处于①、②、③三种不同的环境中.请回答: