题目内容
全世界每年因钢铁锈蚀造成大量的损失.某学生欲探究在蒸馏水、氯化钠溶液和醋酸溶液三种条件下铁锈蚀的快慢,设计了如下实验.| 实验序号 | ① | ② | ③ |
| 实验 内容 |
 |
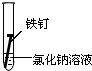 |
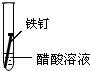 |
(1)在一周的观察过程中,他发现实验序号为
(2)实验②中发生的是
(3)下列防止钢铁锈蚀的措施合理的是
a.在自行车的钢圈表面镀镍
b.在地下钢铁管道上连接铜块
c.改变金属内部结构制成不锈钢
(4)已知铁钉样品质量为4.00g,经实验测得未锈蚀铁的质量分数为70%.则未锈蚀铁与足量稀硫酸反应生成氢气的体积为
分析:(1)形成原电池后能加快金属的腐蚀速率;
(2)金属的腐蚀分为化学腐蚀和电化学腐蚀;
(3)金属的防护措施有牺牲阳极的阴极保护法、外加电流的阴极保护法,另外还有电镀、喷镀、喷油漆等方法使金属与空气、水等物质隔离,以防止金属腐蚀;
(4)根据铁与氢气之间的关系式计算氢气的体积.
(2)金属的腐蚀分为化学腐蚀和电化学腐蚀;
(3)金属的防护措施有牺牲阳极的阴极保护法、外加电流的阴极保护法,另外还有电镀、喷镀、喷油漆等方法使金属与空气、水等物质隔离,以防止金属腐蚀;
(4)根据铁与氢气之间的关系式计算氢气的体积.
解答:解:(1)①蒸馏水中不含氧气,所以铁钉和蒸馏水不能构成原电池;
②铁钉和氯化钠溶液能构成原电池,铁作负极而被腐蚀;
③铁钉和醋酸能发生氧化还原反应而被腐蚀,所以铁钉腐蚀最慢的是①,故答案为:①;
(2)金属的腐蚀分为化学腐蚀和电化学腐蚀,装置②中,铁钉和氯化钠溶液能构成原电池,铁作负极而被腐蚀,属于电化学腐蚀,故答案为:电化学腐蚀;
(3)a.在自行车的钢圈表面镀镍,能阻止钢铁和电解质溶液构成原电池,所以能防腐,故正确;
b.铁、铜和电解质溶液构成原电池,铁比铜活泼,加快了铁的腐蚀,所以不能起到防腐作用,故错误;
c.在金属中加入一些其它物质制成合金,改变了金属的结构,所以能防腐,故正确;
故答案为:ac;
(4)设生成氢气的体积是V,
Fe+H2SO4=FeSO4+H2↑
56g 22.4L
4.00g×70% V
V=
=1.12L,
故答案为:1.12 L(或1120 mL).
②铁钉和氯化钠溶液能构成原电池,铁作负极而被腐蚀;
③铁钉和醋酸能发生氧化还原反应而被腐蚀,所以铁钉腐蚀最慢的是①,故答案为:①;
(2)金属的腐蚀分为化学腐蚀和电化学腐蚀,装置②中,铁钉和氯化钠溶液能构成原电池,铁作负极而被腐蚀,属于电化学腐蚀,故答案为:电化学腐蚀;
(3)a.在自行车的钢圈表面镀镍,能阻止钢铁和电解质溶液构成原电池,所以能防腐,故正确;
b.铁、铜和电解质溶液构成原电池,铁比铜活泼,加快了铁的腐蚀,所以不能起到防腐作用,故错误;
c.在金属中加入一些其它物质制成合金,改变了金属的结构,所以能防腐,故正确;
故答案为:ac;
(4)设生成氢气的体积是V,
Fe+H2SO4=FeSO4+H2↑
56g 22.4L
4.00g×70% V
V=
| 4.00g×70%×22.4L |
| 56g |
故答案为:1.12 L(或1120 mL).
点评:本题考查了金属的腐蚀与防护、氧化还原反应的有关计算等知识点,难度不大,根据金属腐蚀特点选取相应的保护方法.

练习册系列答案
相关题目
 (Ⅰ)如图所示,铁处于Ⅰ、Ⅱ、Ⅲ三种不同的环境中,铁被腐蚀的速率由大到小的顺序是(填序号)
(Ⅰ)如图所示,铁处于Ⅰ、Ⅱ、Ⅲ三种不同的环境中,铁被腐蚀的速率由大到小的顺序是(填序号)