摘要:3.1986年.化学史上第一次用非电解法制得氟气.试配平该反应的化学方程式.指出反应中元素被氧化.是氧化剂. ( )K2MnF6+( )SbF5=( )KSbF6+( )MnF3+( )F2
网址:http://m.1010jiajiao.com/timu3_id_162294[举报]
(I)下图是一些常见的单质.化合物之间的转化关系图,有些反应中的部分物质被略去.A为含14个电子的双原子分子,C.E为金属单质,B化合物中含E原子质量含量为70%.反应①②均为工业上的重要反应.

请回答下列问题:
(1)D的电子式为
 .
.
(2)K的化学式为
(3)写出B与C高温反应生成E和F的化学方程式:
(4)写出D与J的稀溶液反应生成G的离子方程式:
(5)I→L的离子方程式
(II)随着尖端技术的发展,氟的用途日益广泛,如用F2将UF4氧化成UF6,然后用气体扩散法使铀的同位素235U和238U分离.而氟单质的制备通常采用电解氧化法.下图是电解熔融的氟氢化钾(KHF2)和无水氟化氢的混合物,其装置如图:
(1)已知阴极的反应为:2HF2-+2e-=H2+4F-则电解的总反应为:
(2)出口1是(写化学式,下同)
(3)在电解质的熔盐中常加入另一种氟化物(AlF3),他的作用是①减少HF的挥发②
(4)随着电解的进行有一种物质会不断被消耗,需要从入口处进行补充,则从入口处加入的物质是(写化学式)
(5)化学家Karl Chrite首次用化学方法制的氟,这是1986年合成化学研究上的一大突破.具体制法为:
①4KMnO4+4KF+20HF=4K2MnF6+10H2O+3O2
②SbCl5+5HF=SbF5+5HCl
③2K2MnF6+4SbF5
4KSbF6+2MnF3+F2
则下列说法正确的是
A.反应①中KMnO4既是氧化剂又是还原剂,K2MnF6是氧化产物
B.反应③中K2MnF6一定是氧化剂可能还起到还原剂的作用,SbF5一定不是氧化剂
C.反应②能够发生可能原因是生成稳定的络合物SbF5的缘故
D.生成0.5mol的F2整个反应过程中转移的电子总数是4NA个.
查看习题详情和答案>>

请回答下列问题:
(1)D的电子式为


(2)K的化学式为
FeCl3
FeCl3
.(3)写出B与C高温反应生成E和F的化学方程式:
Fe2O3+Al
Fe+Al2O3
| ||
Fe2O3+Al
Fe+Al2O3
.
| ||
(4)写出D与J的稀溶液反应生成G的离子方程式:
CO2+OH-=HCO3-
CO2+OH-=HCO3-
.(5)I→L的离子方程式
Al3++4OH-=AlO2-+2H2O
Al3++4OH-=AlO2-+2H2O
.
(II)随着尖端技术的发展,氟的用途日益广泛,如用F2将UF4氧化成UF6,然后用气体扩散法使铀的同位素235U和238U分离.而氟单质的制备通常采用电解氧化法.下图是电解熔融的氟氢化钾(KHF2)和无水氟化氢的混合物,其装置如图:
(1)已知阴极的反应为:2HF2-+2e-=H2+4F-则电解的总反应为:
2KHF2
2KF+H2↑+F2↑
| ||
2KHF2
2KF+H2↑+F2↑
.
| ||
(2)出口1是(写化学式,下同)
F2
F2
,出口2是H2
H2
.(3)在电解质的熔盐中常加入另一种氟化物(AlF3),他的作用是①减少HF的挥发②
降低电解质的熔点
降低电解质的熔点
.(4)随着电解的进行有一种物质会不断被消耗,需要从入口处进行补充,则从入口处加入的物质是(写化学式)
HF
HF
.(5)化学家Karl Chrite首次用化学方法制的氟,这是1986年合成化学研究上的一大突破.具体制法为:
①4KMnO4+4KF+20HF=4K2MnF6+10H2O+3O2
②SbCl5+5HF=SbF5+5HCl
③2K2MnF6+4SbF5
| ||
则下列说法正确的是
C
C
.A.反应①中KMnO4既是氧化剂又是还原剂,K2MnF6是氧化产物
B.反应③中K2MnF6一定是氧化剂可能还起到还原剂的作用,SbF5一定不是氧化剂
C.反应②能够发生可能原因是生成稳定的络合物SbF5的缘故
D.生成0.5mol的F2整个反应过程中转移的电子总数是4NA个.
(I)下图是一些常见的单质.化合物之间的转化关系图,有些反应中的部分物质被略去.A为含14个电子的双原子分子,C.E为金属单质,B化合物中含E原子质量含量为70%.反应①②均为工业上的重要反应.

请回答下列问题:
(1)D的电子式为______.
(2)K的化学式为______.
(3)写出B与C高温反应生成E和F的化学方程式:______.
(4)写出D与J的稀溶液反应生成G的离子方程式:______.
(5)I→L的离子方程式______.
(II)随着尖端技术的发展,氟的用途日益广泛,如用F2将UF4氧化成UF6,然后用气体扩散法使铀的同位素235U和238U分离.而氟单质的制备通常采用电解氧化法.下图是电解熔融的氟氢化钾(KHF2)和无水氟化氢的混合物,其装置如图:
(1)已知阴极的反应为:2HF2-+2e-=H2+4F-则电解的总反应为:______.
(2)出口1是(写化学式,下同)______,出口2是______.
(3)在电解质的熔盐中常加入另一种氟化物(AlF3),他的作用是①减少HF的挥发②______.
(4)随着电解的进行有一种物质会不断被消耗,需要从入口处进行补充,则从入口处加入的物质是(写化学式)______.
(5)化学家Karl Chrite首次用化学方法制的氟,这是1986年合成化学研究上的一大突破.具体制法为:
①4KMnO4+4KF+20HF=4K2MnF6+10H2O+3O2
②SbCl5+5HF=SbF5+5HCl
③2K2MnF6+4SbF5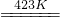 4KSbF6+2MnF3+F2
4KSbF6+2MnF3+F2
则下列说法正确的是______.
A.反应①中KMnO4既是氧化剂又是还原剂,K2MnF6是氧化产物
B.反应③中K2MnF6一定是氧化剂可能还起到还原剂的作用,SbF5一定不是氧化剂
C.反应②能够发生可能原因是生成稳定的络合物SbF5的缘故
D.生成0.5mol的F2整个反应过程中转移的电子总数是4NA个.
查看习题详情和答案>>
|
镓是化学史上第一个事先预言后被发现的新元素,它雄辩地证明了门捷列夫元素周期律的科学性.应用元素周期律的有关知识,可以预测我们不知道的一些元素及其化合物的性质.下列预测中不正确的是 ①Be的氧化物的水化物可能具有两性 ②Tl既能与盐酸又能与NaOH溶液作用产生氢气 ③At单质为有色固体,AgAt不溶于水也不溶于稀硝酸 ④Li在氧气中剧烈燃烧,产物是Li2O2,产物溶于水得到一种强碱溶液 ⑤SrSO4是难溶于水的白色固体 ⑥H2Se是无色,有毒,比H2S稳定的气体 | |
A. |
①②③④ |
B. |
②④⑥ |
C. |
①③⑤ |
D. |
②④⑤ |
1869年,俄国化学家门捷列夫制作出了第一张元素周期表,揭示了化学元素间的内在联系,成为化学史上的重要里程碑之一.下列有关元素周期表的说法正确的是( )
| A、N、Mg、Si、P都是第三周期元素 | B、F、Cl、Br、I都是VIIA的元素 | C、IA族的元素全部是金属元素 | D、短周期是指第一、二、三、四周期 |