题目内容
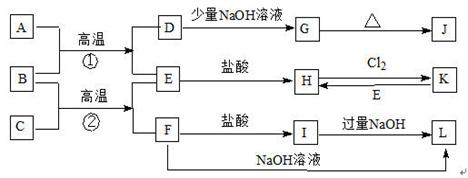
(I)下图是一些常见的单质.化合物之间的转化关系图,有些反应中的部分物质被略去.A为含14个电子的双原子分子,C.E为金属单质,B化合物中含E原子质量含量为70%.反应①②均为工业上的重要反应.

请回答下列问题:
(1)D的电子式为
 .
.
(2)K的化学式为
(3)写出B与C高温反应生成E和F的化学方程式:
(4)写出D与J的稀溶液反应生成G的离子方程式:
(5)I→L的离子方程式
(II)随着尖端技术的发展,氟的用途日益广泛,如用F2将UF4氧化成UF6,然后用气体扩散法使铀的同位素235U和238U分离.而氟单质的制备通常采用电解氧化法.下图是电解熔融的氟氢化钾(KHF2)和无水氟化氢的混合物,其装置如图:
(1)已知阴极的反应为:2HF2-+2e-=H2+4F-则电解的总反应为:
(2)出口1是(写化学式,下同)
(3)在电解质的熔盐中常加入另一种氟化物(AlF3),他的作用是①减少HF的挥发②
(4)随着电解的进行有一种物质会不断被消耗,需要从入口处进行补充,则从入口处加入的物质是(写化学式)
(5)化学家Karl Chrite首次用化学方法制的氟,这是1986年合成化学研究上的一大突破.具体制法为:
①4KMnO4+4KF+20HF=4K2MnF6+10H2O+3O2
②SbCl5+5HF=SbF5+5HCl
③2K2MnF6+4SbF5
4KSbF6+2MnF3+F2
则下列说法正确的是
A.反应①中KMnO4既是氧化剂又是还原剂,K2MnF6是氧化产物
B.反应③中K2MnF6一定是氧化剂可能还起到还原剂的作用,SbF5一定不是氧化剂
C.反应②能够发生可能原因是生成稳定的络合物SbF5的缘故
D.生成0.5mol的F2整个反应过程中转移的电子总数是4NA个.

请回答下列问题:
(1)D的电子式为


(2)K的化学式为
FeCl3
FeCl3
.(3)写出B与C高温反应生成E和F的化学方程式:
Fe2O3+Al
Fe+Al2O3
| ||
Fe2O3+Al
Fe+Al2O3
.
| ||
(4)写出D与J的稀溶液反应生成G的离子方程式:
CO2+OH-=HCO3-
CO2+OH-=HCO3-
.(5)I→L的离子方程式
Al3++4OH-=AlO2-+2H2O
Al3++4OH-=AlO2-+2H2O
.
(II)随着尖端技术的发展,氟的用途日益广泛,如用F2将UF4氧化成UF6,然后用气体扩散法使铀的同位素235U和238U分离.而氟单质的制备通常采用电解氧化法.下图是电解熔融的氟氢化钾(KHF2)和无水氟化氢的混合物,其装置如图:
(1)已知阴极的反应为:2HF2-+2e-=H2+4F-则电解的总反应为:
2KHF2
2KF+H2↑+F2↑
| ||
2KHF2
2KF+H2↑+F2↑
.
| ||
(2)出口1是(写化学式,下同)
F2
F2
,出口2是H2
H2
.(3)在电解质的熔盐中常加入另一种氟化物(AlF3),他的作用是①减少HF的挥发②
降低电解质的熔点
降低电解质的熔点
.(4)随着电解的进行有一种物质会不断被消耗,需要从入口处进行补充,则从入口处加入的物质是(写化学式)
HF
HF
.(5)化学家Karl Chrite首次用化学方法制的氟,这是1986年合成化学研究上的一大突破.具体制法为:
①4KMnO4+4KF+20HF=4K2MnF6+10H2O+3O2
②SbCl5+5HF=SbF5+5HCl
③2K2MnF6+4SbF5
| ||
则下列说法正确的是
C
C
.A.反应①中KMnO4既是氧化剂又是还原剂,K2MnF6是氧化产物
B.反应③中K2MnF6一定是氧化剂可能还起到还原剂的作用,SbF5一定不是氧化剂
C.反应②能够发生可能原因是生成稳定的络合物SbF5的缘故
D.生成0.5mol的F2整个反应过程中转移的电子总数是4NA个.
分析:(I)(1)根基CO2的结构和成键情况来书写电子式;
(2)氯化亚铁和氯化铁之间可以相互转化;
(3)根据铝热反应的原理书写化学方程式;
(4)二氧化碳和少量的氢氧化钠反应生成的是碳酸氢钠;
(5)铝离子能和过量的烧碱反应生成偏铝酸钠,不会出现沉淀;
(II)(1)根据电解池的阳极和阴极发生的电极反应来书写总反应;
(2)根据两个电极反应的产物来回答;
(3)根据氟化物(AlF3)的性质来分析所起的作用;
(4)反应过程中不断地被消耗的物质是电解过程中需要添加的物质;
(5)A、化合价升高元素所在的反应物是还原剂,对应的产物是氧化产物;化合降低元素所在的反应物是氧化剂;
B、氧化剂具有氧化性,起氧化作用;
C、化学反应易向着生成稳定化合物的方向进行;
D、化合价升高数目=化合价降低数目=转移的电子数目.
(2)氯化亚铁和氯化铁之间可以相互转化;
(3)根据铝热反应的原理书写化学方程式;
(4)二氧化碳和少量的氢氧化钠反应生成的是碳酸氢钠;
(5)铝离子能和过量的烧碱反应生成偏铝酸钠,不会出现沉淀;
(II)(1)根据电解池的阳极和阴极发生的电极反应来书写总反应;
(2)根据两个电极反应的产物来回答;
(3)根据氟化物(AlF3)的性质来分析所起的作用;
(4)反应过程中不断地被消耗的物质是电解过程中需要添加的物质;
(5)A、化合价升高元素所在的反应物是还原剂,对应的产物是氧化产物;化合降低元素所在的反应物是氧化剂;
B、氧化剂具有氧化性,起氧化作用;
C、化学反应易向着生成稳定化合物的方向进行;
D、化合价升高数目=化合价降低数目=转移的电子数目.
解答:解:(I)A为含14个电子的双原子分子,结合转化图,则A为CO,反应①②均为工业上的重要反应,推断①是工业生产金属铁的反应,所以B是氧化铁,C是金属铝,则D为CO2,E为Fe,H是氯化亚铁,K为氯化铁,F为Al2O3,I为AlCl3,L为偏铝酸钠.
(1)二K的化学式为氧化碳是直线型非极性分子,电子式为: ,故答案为:
,故答案为: ;
;
(2)K的化学式为FeCl3,故答案为:FeCl3;
(3)金属铝和氧化铁发生铝热反应,方程式为:Fe2O3+Al
Fe+Al2O3,故答案为:Fe2O3+Al
Fe+Al2O3;
(4)二氧化碳和少量的氢氧化钠反应生成的是碳酸氢钠,实质是:CO2+OH-=HCO3-,故答案为:CO2+OH-=HCO3-;
(5)铝离子能和过量的烧碱反应生成偏铝酸钠,实质是:Al3++4OH-=AlO2-+2H2O,故答案为:Al3++4OH-=AlO2-+2H2O;
(II)(1)阴极的反应为:2HF2-+2e-=H2↑+4F-,阳极反应为:2F-→2e-+F2↑,则总的电解反应为:2KHF2
2KF+H2↑+F2↑,故答案为:2KHF2
2KF+H2↑+F2↑;
(2)阴极的反应为:2HF2-+2e-=H2↑+4F-,阳极反应为:2F-→2e-+F2↑,出口1是F2,出口2是H2,故答案为:F2;H2;
(3)氟化物(AlF3)的作用是减少HF的挥发,并能降低电解质的熔点,故答案为:降低电解质的熔点;
(4)反应过程中HF不断地被消耗,可以随时加入,即从入口处加入的物质是HF,故答案为:HF;
(5)A、反应①中KMnO4既是氧化剂又是还原剂,K2MnF6是还原产物,故A错误;
B、反应③中K2MnF6一定是氧化剂,氧化剂具有氧化性,起氧化作用,故B错误;
C、化学反应易向着生成稳定化合物的方向进行,反应②能够发生可能原因是生成稳定的络合物SbF5的缘故,故C正确;
D、反应中化合价升高数目=化合价降低数目=转移的电子数目=2NA,即生成1mol的F2整个反应过程中转移的电子总数是2NA个,当生成0.5mol的F2整个反应过程中转移的电子总数是NA个,故D错误.
故选C.
(1)二K的化学式为氧化碳是直线型非极性分子,电子式为:
 ,故答案为:
,故答案为: ;
;(2)K的化学式为FeCl3,故答案为:FeCl3;
(3)金属铝和氧化铁发生铝热反应,方程式为:Fe2O3+Al
| ||
| ||
(4)二氧化碳和少量的氢氧化钠反应生成的是碳酸氢钠,实质是:CO2+OH-=HCO3-,故答案为:CO2+OH-=HCO3-;
(5)铝离子能和过量的烧碱反应生成偏铝酸钠,实质是:Al3++4OH-=AlO2-+2H2O,故答案为:Al3++4OH-=AlO2-+2H2O;
(II)(1)阴极的反应为:2HF2-+2e-=H2↑+4F-,阳极反应为:2F-→2e-+F2↑,则总的电解反应为:2KHF2
| ||
| ||
(2)阴极的反应为:2HF2-+2e-=H2↑+4F-,阳极反应为:2F-→2e-+F2↑,出口1是F2,出口2是H2,故答案为:F2;H2;
(3)氟化物(AlF3)的作用是减少HF的挥发,并能降低电解质的熔点,故答案为:降低电解质的熔点;
(4)反应过程中HF不断地被消耗,可以随时加入,即从入口处加入的物质是HF,故答案为:HF;
(5)A、反应①中KMnO4既是氧化剂又是还原剂,K2MnF6是还原产物,故A错误;
B、反应③中K2MnF6一定是氧化剂,氧化剂具有氧化性,起氧化作用,故B错误;
C、化学反应易向着生成稳定化合物的方向进行,反应②能够发生可能原因是生成稳定的络合物SbF5的缘故,故C正确;
D、反应中化合价升高数目=化合价降低数目=转移的电子数目=2NA,即生成1mol的F2整个反应过程中转移的电子总数是2NA个,当生成0.5mol的F2整个反应过程中转移的电子总数是NA个,故D错误.
故选C.
点评:本题是一道综合题,考查角度广,难度较大,要求学生具备分析和解决问题的能力.

练习册系列答案
相关题目



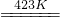 4KSbF6+2MnF3+F2
4KSbF6+2MnF3+F2